Výpis souhrnů
Chemie
Prohlížíte si souhrny informací k určitým tématům. Systémy Umíme se zaměřují hlavně na jejich procvičování. Ke cvičením k jednotlivým podtématům se dostanete pomocí odkazů níže.
Podtémata
- Vlastnosti látek, skupenství
- Směsi
- Atom, prvky
- Radioaktivita
- Elektronová konfigurace, kvantová čísla
- Chemická vazba, molekuly
- Chemická vazba: pokročilejší souvislosti
- Ionty
- Prvky, molekuly a počet částic
- Úvod do chemických reakcí
- Vyčíslování chemických rovnic
- Redoxní reakce
- Elektrochemie
- Kyselost a zásaditost roztoků, pH
- Látkové množství, molární hmotnost
- Výpočty z chemických rovnic
- Látková koncentrace
- Hmotnostní zlomek
- Výpočty z chemických vzorců
- Skupiny chemických látek
- Periodická tabulka prvků
- Orientace v periodické tabulce
- Prvky: značky
- Kyslík, vodík
- Užitné kovy
- Halogenidy
- Oxidy
- Sulfidy
- Kyseliny a hydroxidy
- Soli
- Organická chemie
- Organická chemie obecně
- Úvod do organické chemie
- Zdroje organických látek (ropa, uhlí, zemní plyn)
- Reakce v organické chemii, indukční a mezomerní efekt
- Uhlovodíky
- Uhlovodíky: (cyklo)alkany/alkeny/alkyny
- Aromatické uhlovodíky
- Deriváty uhlovodíků
- Halogenderiváty a dusíkaté deriváty uhlovodíků
- Alkoholy, fenoly, ethery
- Aldehydy, ketony
- Karboxylové kyseliny
- Deriváty karboxylových kyselin
- Biochemie
- Lipidy
- Sacharidy
- Proteiny
- Enzymy
- Nukleové kyseliny
- Vitaminy
- Fotosyntéza
- Bezpečnost v chemii
- Voda: základy a koloběh
- Využívání vody
- Vzduch: základy
- Znečištění ovzduší
- Složení lidského těla: přehled
- Anorganické látky v lidském těle
- Stavební materiály
- Vybavení kuchyně
- Látky v potravinách
- Reakce v kuchyni, příprava jídla
- Rozpouštědla a povrchově aktivní látky
- Koupelna, kosmetika
- Plasty
- Chemie a výroba elektřiny
Vlastnosti látek, skupenství
Chemická látka je forma hmoty. Má určité složení a strukturu, sestává z částic (molekul, atomů/iontů). Látkami jsou tvořena tělesa.
Skupenství látek
- Látky v pevném skupenství mají těsně uspořádané částice, ty se výrazněji nepohybují. Pevná tělesa mají stálý tvar a objem.
- Látky v kapalném skupenství mají částice jsou blízko sebe, ale mohou se volně pohybovat. Kapalná tělesa mají stálý objem, tvar mění podle nádoby.
- Látky v plynném skupenství mají částice daleko od sebe, tyto částice na sebe víceméně nepůsobí.
Kapaliny a plyny se souhrnně označují jako tekutiny.
Skupenské přeměny
Skupenství látek je závislé na teplotě a tlaku. Změna těchto podmínek vede ke změnám skupenství:
Jako var se označuje jev, kdy se kapalina vypařuje v celém svém objemu. Více skupenství určité látky může existovat současně: např. vodní pára se ve vzduchu nachází, aniž by bylo dosaženo teploty varu.
Vlastnosti látek a jejich zkoumání
Mezi fyzikální vlastnosti látek patří např. skupenství, barva, elektrická vodivost, tvrdost či hustota. Mezi chemické vlastnosti náleží např. reaktivita, hořlavost, pH (kyselost/zásaditost) či rozpustnost. Vlastnosti látek lze zkoumat např. měřením, pozorováním či pokusem.
NahoruSměs se skládá z více chemických látek (respektive více chemicky čistých látek). Při jejich mísení nedochází ke změnám vazeb. Mohou se však měnit fyzikální vlastnosti: např. voda se solí má nižší teplotu tání než čistá voda.
Stejnorodé směsi
Stejnorodé (homogenní) směsi se také označují jako roztoky. Jejich součásti nelze odlišit okem ani mikroskopem. Mohou být pevné (např. slitiny kovů), kapalné (např. sůl rozpuštěná ve vodě) či plynné (složky vzduchu, propan-butan).
Různorodé směsi
Různorodé (heterogenní) směsi sestávají ze složek, které lze vzájemně odlišit.
| Typ různorodé směsi | Obsažené látky (fáze) | Konkrétní příklad |
|---|---|---|
| suspenze | pevná látka v kapalině | písek rozptýlený ve vodě |
| emulze | kapalina rozptýlená v jiné kapalině, tyto kapaliny jsou vzájemně nemísitelné | olej ve vodě, majonéza |
| pěna | plyn v kapalině | pěnící šampon |
| aerosol | kapalina/pevná látka v plynu | mlha, dým, kouř |
Koloidní směsi
Koloidní směsi mají částice velké \mathrm{10^{-7}–10^{-9}\;m}, tedy na pomezí stejnorodých a různorodých směsí.
Oddělování složek směsí
Mezi metody oddělování složek směsí patří například:
- sedimentace (usazování) – Obvykle oddělování pevné a kapalné látky, založena na rozdílných hustotách.
- krystalizace – Oddělení rozpuštěné pevné pátky z roztoku, např. krystalizace mořské soli.
- filtrace – Zachycování pevné látky na filtru (např. síto, písek, tkanina, filtrační papír aj.).
- chromatografie – Metoda, při níž složky mobilní fáze různou rychlostí putují stacionární fází (často chromatografickou kolonou), používá se v analytické chemii.
- destilace – Oddělování kapalných složek směsi na základě jejich rozdílných teplot varu, např. destilace při výrobě alkoholických nápojů či frakční destilace ropy.
Atom, prvky
Atom je základní stavební částice hmoty.
Stavba atomu
Atomové jádro obsahuje kladně nabité protony (\mathrm{p^+}) a elektricky neutrální neutrony (\mathrm{n^0}). Protony a neutrony se souhrnně označují jako nukleony. Vně jádra se nachází elektronový obal, který obsahuje záporně nabité elektrony (\mathrm{e^-}). Ty se zde nacházejí ve „vrstvách“. Elektrony náležící do energeticky nejvýše položené vrstvy se označují jako valenční, ty zodpovídají za většinu chemických vlastností látky, kterou tvoří.
Počet protonů a počet elektronů v atomu je v základu stejný, atom jako celek je tedy elektricky neutrální.
Zobrazení atomu jsou pouze modely
Jednotlivé atomy jsou menší než vlnová délka viditelného světla, nelze je tedy přímo pozorovat/zobrazit. Vyobrazení atomů v učebních materiálech jsou jen modely, které přibližují rozložení částí atomu. Zhruba odpovídají Bohrově modelu atomu, který byl aktuální zhruba před 100 lety.
Co se týče těchto modelů, mnohdy také vyvolávají zkreslenou představu o velikostech. Např. jádro atomu uhlíku (\mathrm{C}) je asi 26 000× menší než celý atom. Uvažujme, že Moravské náměstí v Brně má zhruba velikost kruhu o průměru 150 m. \frac{1}{26\,000} by odpovídala asi 6 cm (o něco méně než je průměr tenisového míčku). Většina atomu je tedy „prázdný prostor“ (v rámci obalu se v něm s určitou pravděpodobností mohou vyskytovat elektrony).
Chemické prvky
Chemický prvek je látka složená z atomů, které mají ve svých jádrech určitý počet protonů. Prvky se popisují značkami (např. \mathrm{O} = kyslík, \mathrm{Co} = kobalt). Značky se píší vždy s velkým počátečním písmenem (další písmena jsou malá), hláskují se (např. \mathrm{Al} = [á el]). Názvy prvků v češtině začínají malým písmenem (např. hliník).
Počet protonů v jádře atomu popisuje protonové číslo (značí se Z, zapisuje se jako dolní index před značku prvku. Tedy například: \mathrm{_{8}O} – atomy s protonovým číslem 8 tvoří prvek kyslík (\mathrm{O}), \mathrm{_{15}P} – atomy s protonovým číslem 15 tvoří prvek fosfor (\mathrm{P}).
Nukleonové číslo (A) značí počet částic v jádře atomu, píše se jako horní index před značku prvku. Neutronové číslo (N) se obvykle neuvádí, spočítá se jako rozdíl nukleonového a protonového čísla: N = A - Z.
Příklad: protonové, nukleonové a neutronové číslo
\mathrm{^{238}_{\phantom{0}92}{U}} – Tato konkrétní forma prvku uranu má ve svých atomech 238 částic v jádře, z toho 92 částic jsou protony. Počet neutronů (neutronové číslo) se tedy spočítá jako rozdíl nukleonového a protonového čísla: 238 - 92 = 146.
Izotopy
Izotopy jsou varianty chemického prvku, které mají stejné protonové číslo (tedy obsazují stejné místo periodické tabulky), ale liší se neutronovým číslem. Izotopy se mezi sebou mohou lišit tím, zda jsou stabilní či podléhají radioaktivní přeměně. Příkladem mohou být izotopy vodíku:
| Značka | Název izotopu | Protonů | Neutronů | Stabilní |
|---|---|---|---|---|
| \mathrm{^{1}_{1}H} | protium | 1 | 0 | ano |
| \mathrm{^{2}_{1}H} | deuterium | 1 | 1 | ano |
| \mathrm{^{3}_{1}H} | tritium | 1 | 2 | ne, poločas rozpadu 12,32 let |
Množina atomů s odpovídajícím protonovým a nukleonovým číslem se označuje jako nuklid.
Periodická tabulka prvků
Prvky jsou na základě svých protonových čísel a opakujících se vlastností uspořádány v periodické tabulce (soustavě).
NahoruRadioaktivita
Radioaktivita je jev, při němž dochází k přeměně jader atomů (např. i na jádra jiných prvků). Zároveň může vznikat vysokoenergetické ionizující záření. Poločas přeměny (T_{\frac{1}{2}}) je doba, během níž dojde k přeměně poloviny jader ve vzorku.
Radionuklidy
Radioaktivní nuklidy (radionuklidy) se přirozeně vyskytují v přírodě. Přirozenou radioaktivitu popsal Henri Becquerel u solí uranu, radioaktivitou se dále zabývala Marie Curie-Skłodowská, která mj. popsala prvky radium a polonium. Radionuklidy lze též uměle připravovat působením jiných částic či záření na atomy.
Typy záření
- záření α – Jedná se o rychle se pohybující jádra helia \mathrm{^{4}_{2}He}. Při jejich vyzáření vzniká nuklid, který má o 4 nukleony a 2 protony méně než původní atom: ^A_Z{X} \longrightarrow {^{A-4}_{Z-2}{Y}} + \mathrm{^4_2{He}}.
- záření β – Jde o proud elektronů (přeměna β⁻) či pozitronů (přeměna β⁺). Vznik β⁻ záření popisuje rovnice ^A_Z{X} \longrightarrow {^{\phantom{Z+\!}A}_{Z+1}{Y}} + \mathrm{^{\phantom{1}0}_{–1}{e}} (vzniká nuklid s protonovým číslem vyšším o 1).
- záření γ – Je elektromagnetické vlnění s vysokou energií, je značně pronikavé.
Vliv ionizujícího záření, jednotky
Ionizující záření ničí/mění biomolekuly, čímž mj. způsobuje mutace. Vystavení tomuto záření tedy buď přímo poškozuje tkáně, nebo např. zvyšuje riziko vzniku zhoubných nádorů. Zvýšená expozice tomuto záření nastává při cestách do vesmíru (mimo magnetické pole Země). Absorbovaná dávka záření se vyjadřuje v jednotce gray (Gy), ekvivalentní dávka záření (bere v potaz různé působení záření na tkáně) má jednotku sievert (Sv).
Využití ionizujícího záření
Ionizující záření se využívá v lékařství (radioterapie), neboť nádorové buňky jsou k němu obvykle citlivé. Další využití v lékařství má radioaktivita v rámci zobrazovacích metod (např. pozitronová emisní tomografie = PET).
Zkoumání přítomnosti určitých nuklidů prvků se využívá při datování hornin či paleontologických či archeologických nálezů. Neřízené řetězové jaderné reakce jsou principem fungování jaderných zbraní.
Štěpné jaderné reakce zahrnují rozpad těžšího jádra na jádra lehčí, využívají se např. v jaderných elektrárnách. Při termonukleární fúzi dochází ke spojování lehkých jader za vzniku jader těžších, tento děj probíhá zejména v nitru hvězd. V plánu je dosáhnout řízené termojaderné fúze na Zemi a využívat ji jako energetický zdroj.
NahoruElektronová konfigurace, kvantová čísla
Chemické vlastnosti určitého prvku jsou ovlivněny zejména stavbou elektronového obalu jeho atomů.
Elektrony, orbitaly
Elektrony mají dle kvantově mechanického modelu charakter vlny i částice (to se označuje jako dualismus). Nelze např. současně určit jejich polohu a hybnost, lze určit jen pravděpodobnost, s níž se budou vyskytovat v určitém prostoru. Oblast s určitou pravděpodobností výskytu elektronu (obvykle >95 %) se nazývá orbital.
Kvantová čísla
Stav elektronu lze popsat pomocí kvantových čísel:
- Hlavní kvantové číslo (n) je přirozené číslo. Souvisí s energií elektronů a velikostí orbitalů (čím větší n, tím se elektrony mohou nacházet dále od jádra).
- Vedlejší kvantové číslo (l) udává typ orbitalu, spočítá se dle vztahu l = n - 1. Podle vedlejšího kvantového čísla se orbitaly označují písmeny: 0 = s, 1 = p, 2 = d, 3 = f.
Tvary orbitalů, souvislosti

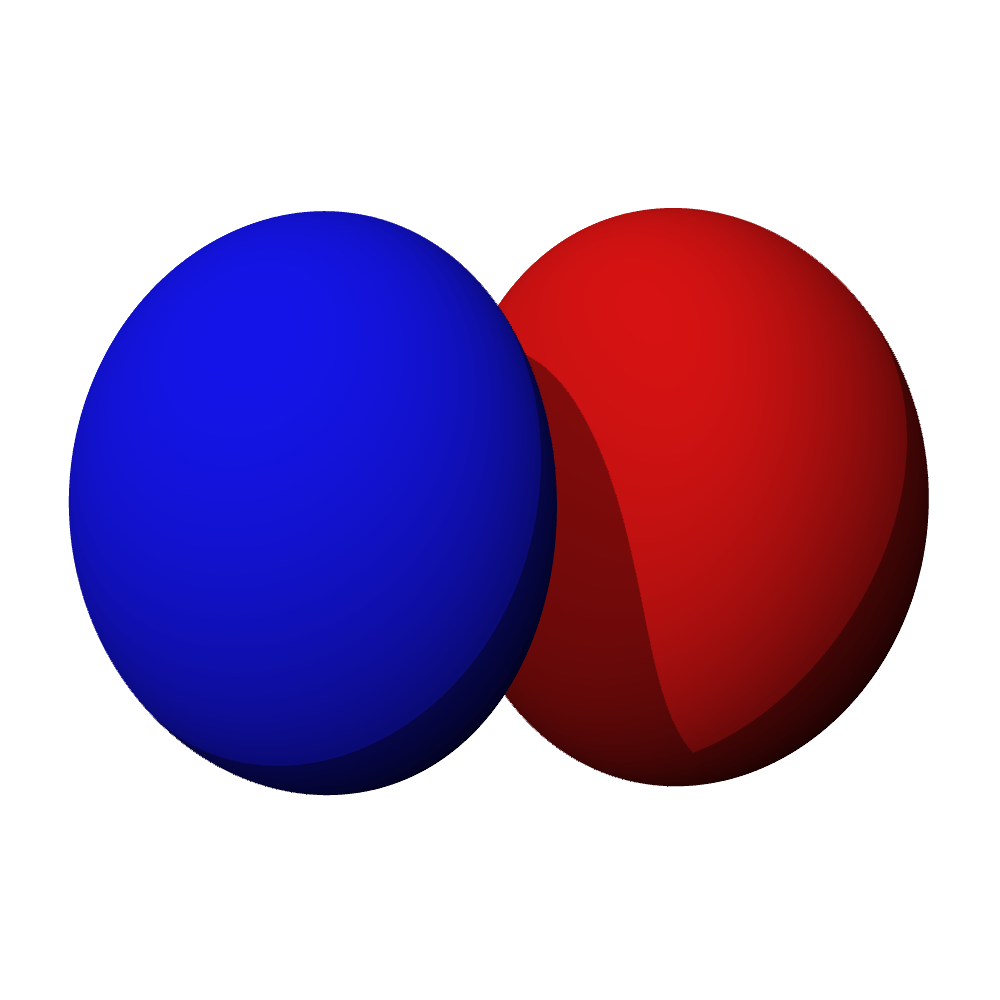
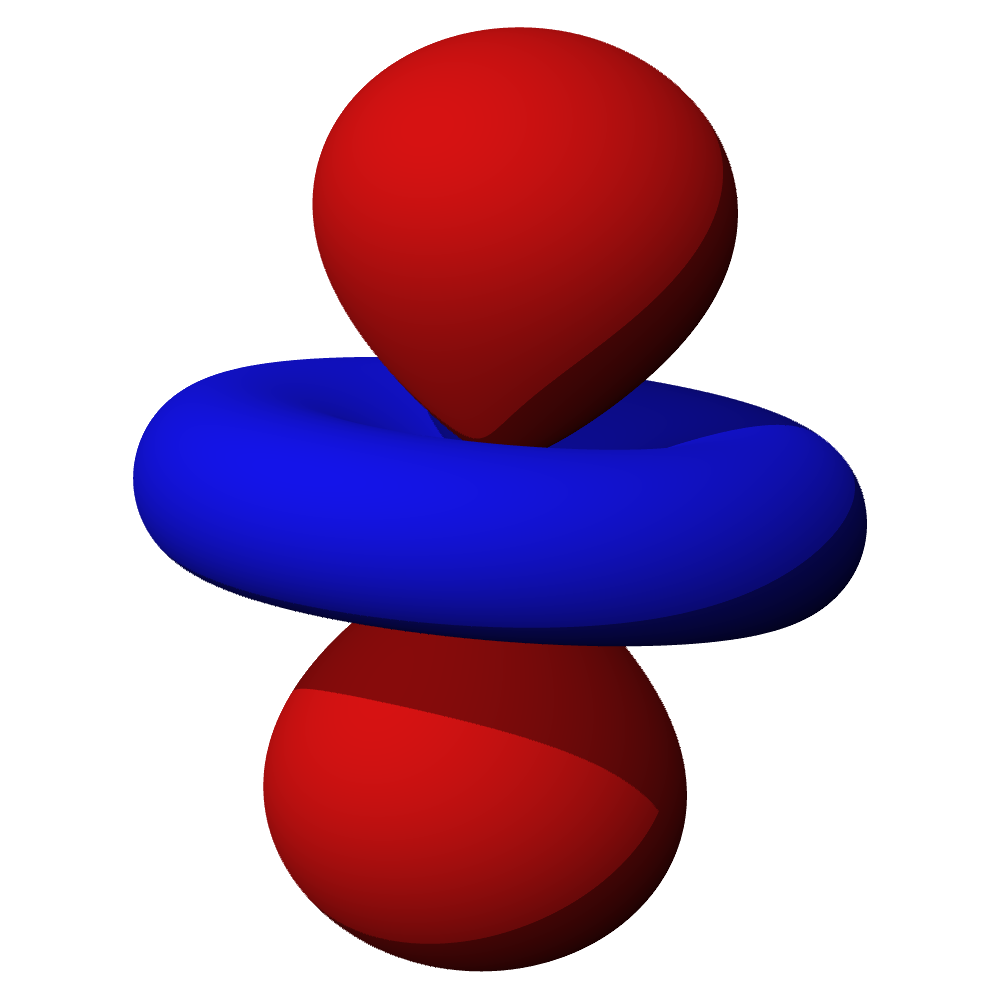
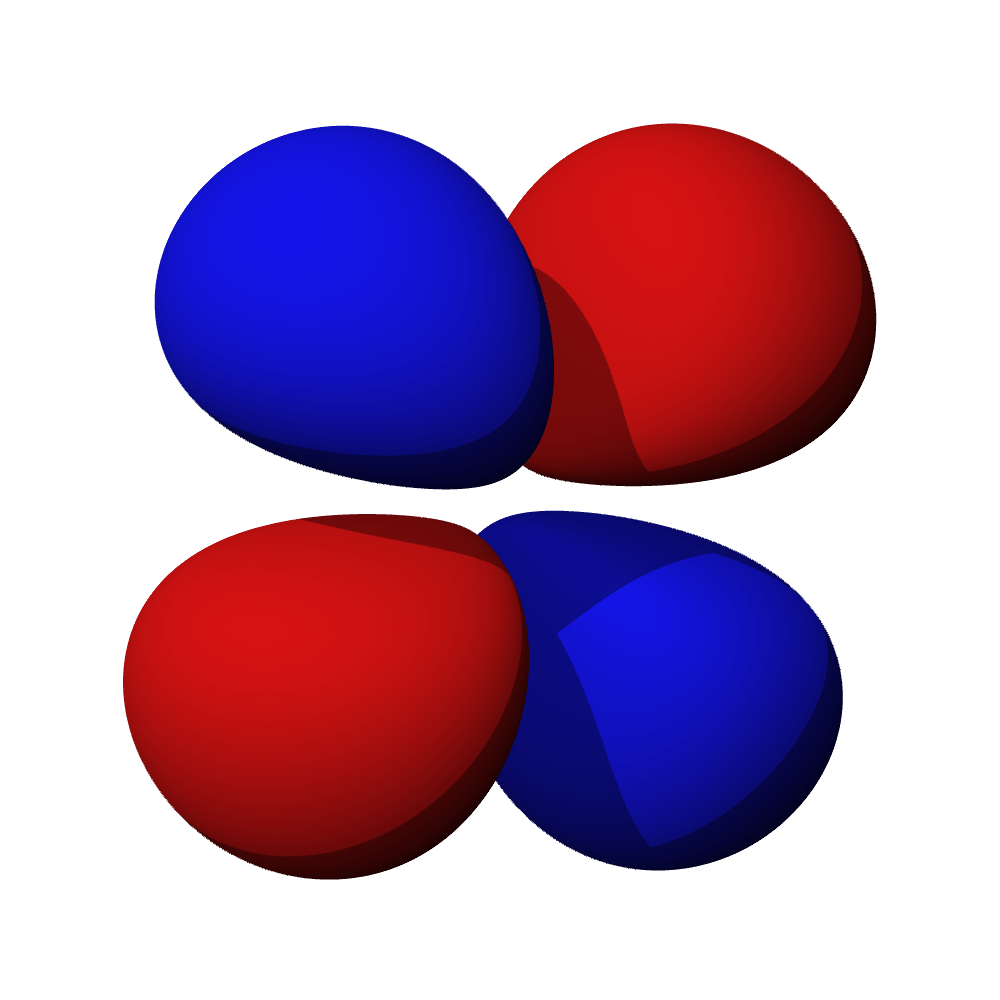
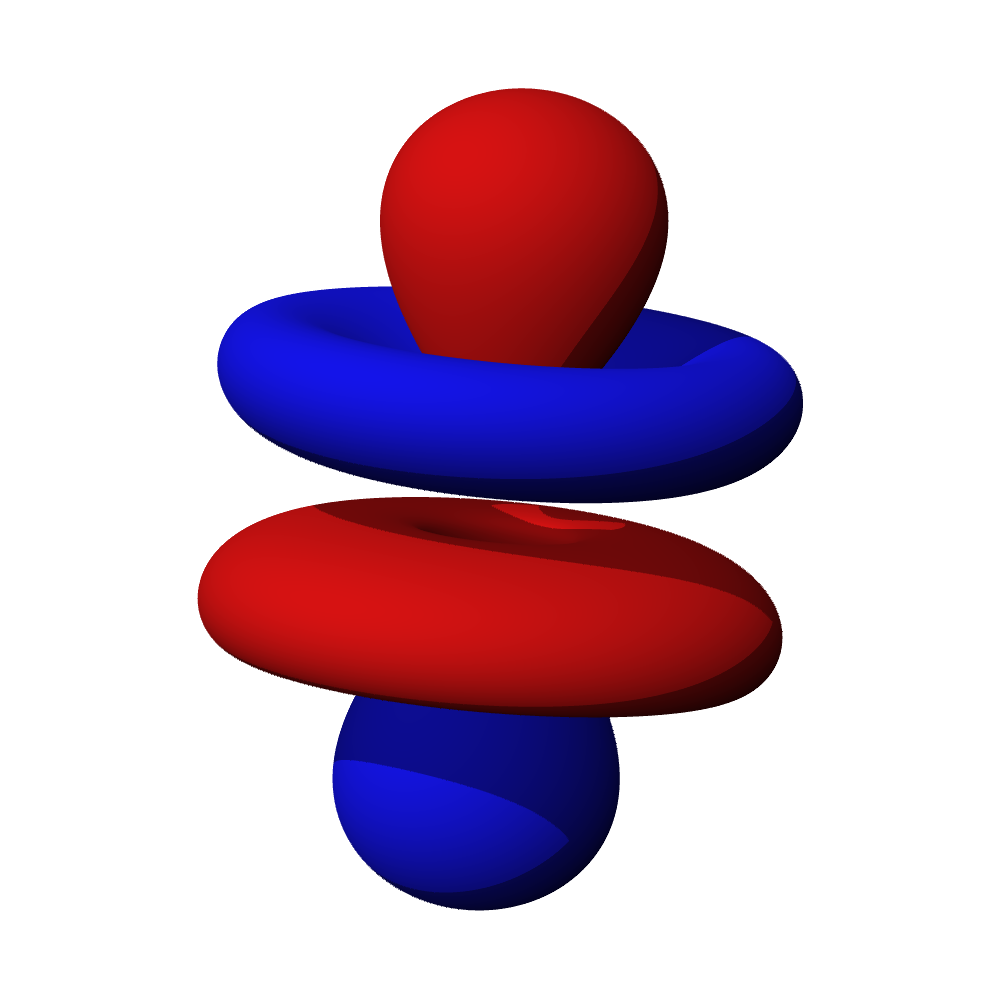
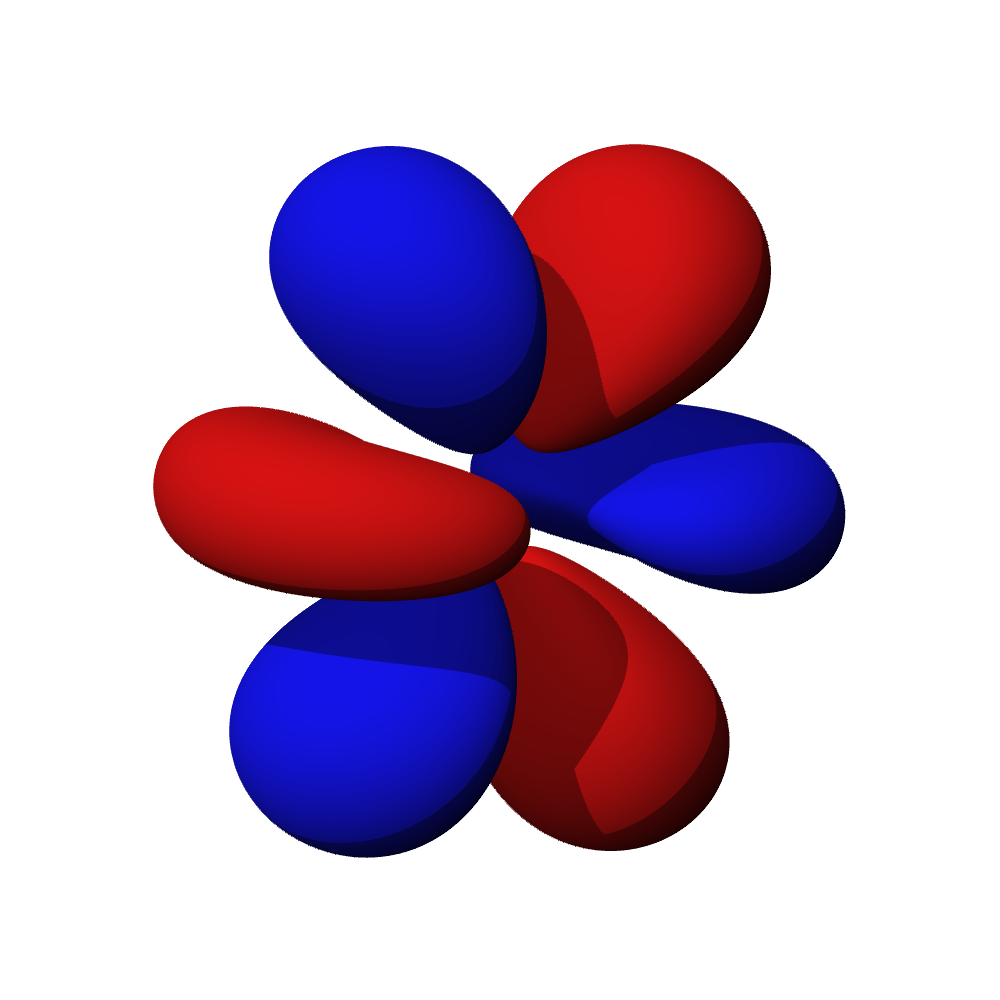
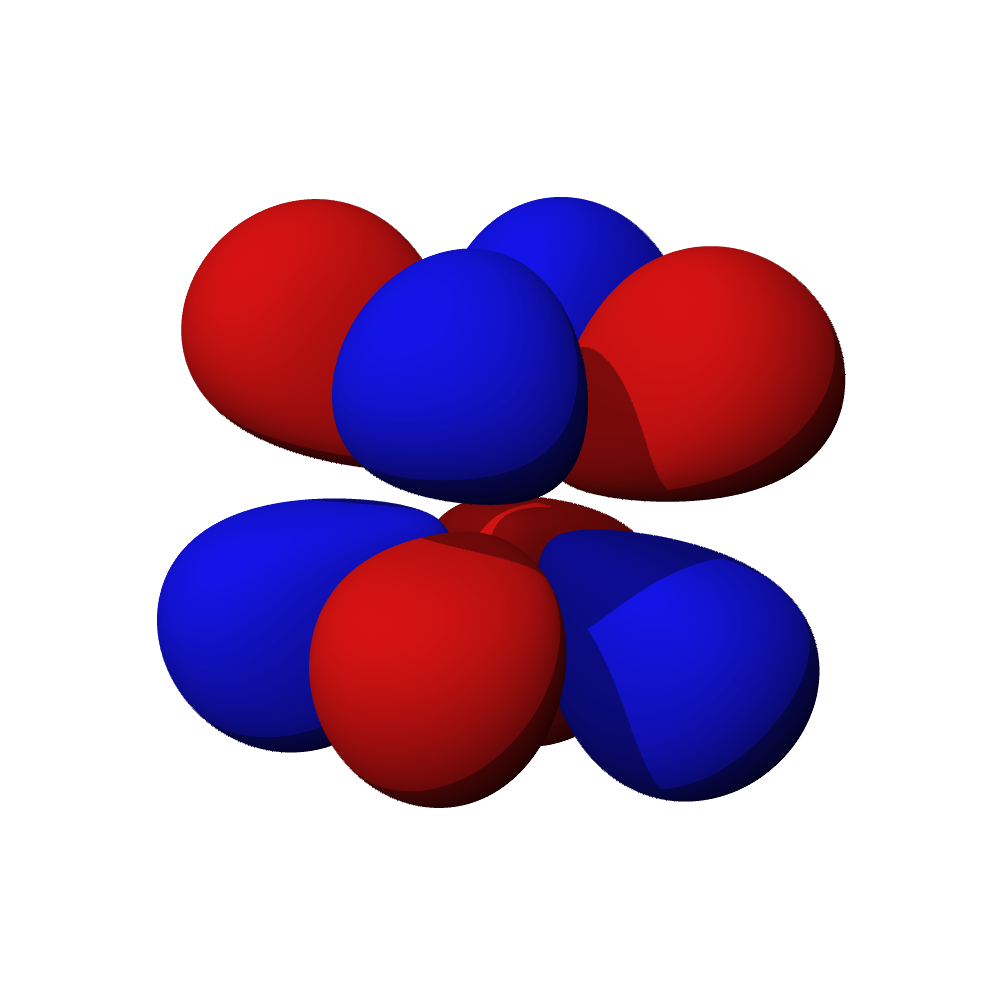
- Orbitaly s mají tvar koule. Orbitaly p se podobají dvěma lalokům. Tvary orbitalů d a f jsou komplexnější.
- Orbital d obsazují přechodné kovy, orbital f vnitřně přechodné kovy (lanthanoidy, aktinoidy). Prvky obsazující orbital g zatím nebyly objeveny.
- Magnetické kvantové číslo (m) udává prostorovou orientaci orbitalu, nabývá celočíselných hodnot od -l do l (včetně 0). Počet magnetických kvantových čísel pro určité vedlejší kvantové číslo souvisí s počtem případných degenerovaných orbitalů (orbitaly, které mají při stejné energii různou prostorovou orientaci).
Příklad: magnetické kvantové číslo
Pokud je vedlejší kvantové číslo l = 1 (typ orbitalu p) jsou magnetická kvantová čísla m = -1; 0; 1: \boxed{\phantom{\uparrow \downarrow} }\,\boxed{\phantom{\uparrow \downarrow} }\,\boxed{\phantom{\uparrow \downarrow} }. Typ orbitalu p se tedy rozděluje na tři degenerované orbitaly s různou prostorovou orientací.
- Spinové kvantové číslo (s) charakterizuje spin elektronu, nabývá hodnoty \frac{1}{2} či - \frac{1}{2}. V grafickém znázornění šipka značí elektron, spin se vyjadřuje směrem šipky (např. \boxed{\uparrow \downarrow }).
Valenční elektrony
Za chemické vlastnosti atomů zodpovídají zejména valenční elektrony, ty se nacházejí v orbitalech s nejvyšším hlavním kvantovým číslem (u přechodných kovů i s druhým nejvyšším). Mohou tedy být nejdále od jádra a mají nejvyšší energii.
Částice nepřechodných prvků jsou obvykle stabilní, když jejich valenční vrstva odpovídá valenční vrstvě vzácného plynu (neboli obsahuje nejčastěji 8 elektronů = oktet). To je důvodem, proč některé prvky ochotně tvoří ionty (např. \mathrm{O^{2-}}, \mathrm{F^{-}}, \mathrm{Na^{+}}, \mathrm{Mg^{2+}} mají 8 valenčních elektronů jako neon).
Elektronová konfigurace
Elektronová konfigurace popisuje uspořádání elektronů v orbitalech. U zkráceného textového zápisu se zahrnuje předchozí vzácný plyn, explicitně jsou tedy vypsány jen valenční elektrony:
| Prvek | Schematický zápis (šipka = elektron) | Textový zápis | Zkrácený textový zápis |
|---|---|---|---|
| lithium (\mathrm{Li}) | \mathrm{1s}\,\boxed{\uparrow\downarrow}\;\mathrm{2s}\,\boxed{\uparrow\ } | \mathrm{1s^2}\,\mathrm{2s^1} | \mathrm{[He]}\,\mathrm{2s^1} |
| hořčík (\mathrm{Mg}) | \mathrm{1s}\,\boxed{\uparrow\downarrow}\;\mathrm{2s}\,\boxed{\uparrow\downarrow}\;\mathrm{2p}\,\boxed{\uparrow \downarrow}\,\boxed{\uparrow \downarrow}\,\boxed{\uparrow \downarrow}\;\mathrm{3s}\,\boxed{\uparrow \downarrow } | \mathrm{1s^2}\,\mathrm{2s^2}\,\mathrm{2p^6}\,\mathrm{3s^2} | \mathrm{[Ne]}\,\mathrm{3s^2} |
V rámci elektronové konfigurace platí:
- Pauliho princip výlučnosti – V atomu není více elektronů, které by měly všechna kvantová čísla stejná. V jednom orbitalu mohou být nanejvýš dva elektrony lišící se spinovým číslem (např. \boxed{\uparrow \downarrow }).
- Hundovo pravidlo – Degenerované orbitaly (orbitaly se stejnou energií) se nejprve zaplňují vždy nejprve jedním elektronem, pak až dvěma. Příklad na orbitalu p se 3 elektrony: \boxed{\uparrow\ }\,\boxed{\uparrow\ }\,\boxed{\uparrow\ }, se 4 elektrony: \boxed{\uparrow\downarrow}\,\boxed{\uparrow\ }\,\boxed{\uparrow\ }.
- výstavbový princip – Orbitaly s nižší energií se zaplňují dříve než orbitaly s vyšší energií (1s, 2s, 2p, 3s, 3p, 4s…).
Excitovaný stav
Při excitaci atomu elektron či elektrony přijmou energii a dostávají se do orbitalu s vyšší energií (poruší výstavbový princip). Níže je příklad elektronové konfigurace atomu \mathrm{C} a excitovaného atomu \mathrm{C}. \mathrm{C\!: 1s\,\boxed{\uparrow\downarrow}\;2s\,\boxed{\uparrow\downarrow}\;2p\,\boxed{\uparrow\ }\,\boxed{\uparrow\ }\,\boxed{\phantom{\uparrow}\ }}
\mathrm{C^*\!: 1s\,\boxed{\uparrow\downarrow}\;2s\,\boxed{\uparrow\ }\;2p\,\boxed{\uparrow\ }\,\boxed{\uparrow\ }\,\boxed{\uparrow\ }}
NahoruChemická vazba, molekuly
Částice mohou být stabilnější, pokud se sloučí s jinými částicemi, neboli mezi sebou vytvoří chemickou vazbu. Vazeb se účastní valenční elektrony, nové vazby se tvoří při chemických reakcích. Díky chemickým vazbám mohou vznikat molekuly (částice z více atomů/iontů), ale také sloučeniny (ty obsahují více různých prvků).
V rámci jednoduché kovalentní vazby jsou atomy spojené díky elektronovému páru. Kovalentních vazeb mezi atomy může být i více, na dvojné vazbě se podílí 2 elektronové páry (4 elektrony), na trojné se podílí 3 elektronové páry (6 elektronů). Díky kovalentní vazbě atomy mnohdy dosahují elektronové konfigurace nejbližšího vzácného plynu.
Elektronegativita je schopnost atomu přitahovat (vazebné) elektrony. Její hodnotu lze najít v periodické tabulce. Dle polarity – rozdílu elektronegativit (\Delta\chi) zúčastněných atomů – se rozlišuje:
- nepolární vazba – Vazebné elektrony jsou rozloženy téměř rovnoměrně (\Delta\chi \lt 0{,}4).
- polární vazba – Vazebné elektrony jsou posunuty k atomu s vyšší elektronegativitou (\Delta\chi = 0{,}4{-}1{,}7).
- iontová vazba – Tvoří se ionty (\Delta\chi \gt 1{,}7).
Hranice mezi výše uvedenými typy vazeb jsou neostré. Obvykle platí, že polární (iontové) látky se rozpouštějí v polárních rozpouštědlech, nepolární v nepolárních.
NahoruChemická vazba: pokročilejší souvislosti
Základním a častým typem vazby je kovalentní vazba. Kovalentní vazba může být:
- jednoduchá – Vazba σ (sigma), u té je elektronová hustota je nejvyšší na spojnicích jader atomů účastnících se vazby. Dochází ke sdílení jednoho elektronového páru.
- dvojná – Tvořena vazbou σ a vazbou π (pí, u vazby π se překrývají orbitaly mimo spojnici jader). Dochází ke sdílení dvou elektronových párů.
- trojná – Sestává z jedné vazby σ a dvou vazeb π. Sdílejí se tři elektronové páry.
Kromě kovalentní vazby existují další typy vazeb.
Koordinačně kovalentní vazba
V rámci této vazby je jeden atom dárce (donor) elektronového páru a druhý je příjemce (akceptor). Uplatňuje se např. při vzniku amonného kationtu (\mathrm{NH_4^+}, \mathrm{N} poskytuje elektronový pár) nebo u komplexních sloučenin.
Kovová vazba
Vzniká v kovech v tuhém stavu, kde valenční elektrony vytvářejí tzv. elektronový plyn a volně se pohybují mezi kationty kovů. Tato vazba podmiňuje vlastnosti kovů: elektrickou a tepelnou vodivost, kujnost a tažnost.
Slabé vazebné interakce
Vodíkové můstky vznikají mezi atomem vodíku a atomem s vysokou elektronegativitou (\mathrm{F}, \mathrm{O}, \mathrm{N}), který obsahuje aspoň jeden volný elektronový pár. Zvyšují teplotu varu látek (např. vody), jsou zásadní třeba pro stavbu dvoušroubovice DNA.
Van der Waalsovy síly jsou slabší než vodíkové můstky, díky nim se na určitou vzdálenost přitahují/odpuzují všechny typy částic.
NahoruIonty jsou elektricky nabité částice, které vznikají z atomů (či molekul) přijetím či odevzdáním elektronů.
- Kationty jsou kladně nabité, počet elektronů v nich je nižší než počet protonů.
- Anionty jsou záporně nabité, počet elektronů v nich je vyšší než počet protonů.
Kation(t), anion(t)
V 1. pádu jednotného čísla se názvy iontů obvykle píší bez „t“ na konci (kation, anion), varianta s „t“ na konci je méně častá, ale také správně (kationt, aniont). Při skloňování či v množném čísle se ovšem „t“ ve slovech vyskytuje (kationtu, kationty).
Náboj iontů se vyznačuje arabskou číslicí a znaménkem (nebo jen znaménkem) v horním indexu za značkou prvku. Např. \mathrm{Al^{3+}} = kation hlinitý. Oproti elektricky neutrálnímu atomu hliníku (13 elektronů) má o 3 elektrony méně (10 elektronů).
Při pojmenovávání kationtů se používají koncovky, které vyjadřují jejich náboj:
| Náboj iontu | Koncovka | Příklad |
|---|---|---|
| \mathrm{+} | -ný | \mathrm{Na^+} = kation sodný |
| \mathrm{2+} | -natý | \mathrm{Mg^{2+}} = kation hořečnatý |
| \mathrm{3+} | -itý | \mathrm{Fe^{3+}} = kation železitý |
Náboj × oxidační číslo iontů
- Oxidační číslo je myšlený (formální) náboj částice.
- U iontů vzniklých z jednotlivých atomů oxidační číslo obvykle odpovídá jejich reálnému náboji. V zásadě je tedy možné např. zaměňovat zápis \mathrm{Mg^{2+}} a \mathrm{Mg^{II}}.
- Pro hodnotu kladných oxidačních čísel a nábojů se také používají stejné názvoslovné koncovky.
Názvy jednoatomových aniontů končí na -idový, např. \mathrm{Cl^-} = anion chloridový. Anionty odvozené od kyslíkatých kyselin mají koncovku -anový, např. \mathrm{{SO_3}^{2-}} = anion siřičitanový.
NahoruPrvky, molekuly a počet částic
Prvky
Chemické prvky se popisují určitou značkou, která sestává z jednoho či dvou písmen. První písmeno je vždy velké. Např. \mathrm{N} = dusík, \mathrm{Fe} = železo.
Molekuly
Více atomů může tvořit molekuly, jejich složení se vyjadřuje chemickým vzorcem. Pokud se v molekule nachází více atomů určitého prvku, tento počet se vyjádří arabskou číslicí za značkou prvku v dolním indexu. Např. \mathrm{N_2} = dvouatomová molekula dusíku.
Sloučeniny
Molekuly sloučenin se skládají z více různých prvků. Např. sloučenina oxid dusitý má vzorec \mathrm{N_2O_3}, každá jeho molekula se skládá ze dvou atomů dusíku (\mathrm{N}) a tří atomů kyslíku (\mathrm{O}). Počet částic v dolním indexu se vždy týká jen nejbližší předcházející značky prvku, tedy např. číslo 3 u značky kyslíku (\mathrm{O}) nesouvisí s počtem atomů dusíku (\mathrm{N}).
Pokud se některá částice v molekule nachází pouze jednou, např. uhlík (\mathrm{C}) v oxidu uhličitém (\mathrm{CO_2}), číslice 1 se nepíše.
V chemických vzorcích je možné pomocí závorek vyjadřovat i větší počet skupin atomů. Např. molekula dusičnanu vápenatého – \mathrm{Ca(NO_3)_2} – sestává z 1 atomu vápníku (\mathrm{Ca}), 2 atomů dusíku (\mathrm{N}) a 6 atomů kyslíku (\mathrm{O}). Číslem za závorkou tedy „roznásobujeme“ počet částic každého prvku v závorce.
Příklady
| Vzorec | Počty jednotlivých atomů v molekule | Celkem atomů | Celkem různých prvků |
|---|---|---|---|
| \mathrm{(NH_4)_3PO_4} | 3 atomy \mathrm{N} 12 atomů \mathrm{H} 1 atom \mathrm{P} 4 atomy \mathrm{O} |
20 | 4 |
| \mathrm{Al(OH)_3} | 1 atom \mathrm{Al} 3 atomy \mathrm{O} 3 atomy \mathrm{H} |
7 | 3 |
| \mathrm{H_2SO_3} | 2 atomy \mathrm{H} 1 atom \mathrm{S} 3 atomy \mathrm{O} |
6 | 3 |
Úvod do chemických reakcí
Chemická reakce je děj, při němž dochází ke změnám chemických vazeb. Látky vstupující do reakce (výchozí látky, edukty) se mění na produkty. Všechny látky účastnící se chemické reakce se nazývají reaktanty.
Chemické rovnice
Průběh chemické reakce se zapisuje chemickou rovnicí. Jednotlivé zúčastněné látky se oddělují znaménkem „+“, mezi výchozí látky a produkty reakce se zapisuje šipka (⟶).
\mathrm{C + O_2 \longrightarrow CO_2}
Rovnice výše lze přečíst takto: uhlík reaguje s dvouatomovou molekulou kyslíku (kyslíkem), vzniká oxid uhličitý.
Počet částic jednotlivých prvků ve výchozích látkách a produktech je stejný, platí zákon zachování hmotnosti. To se vyjadřuje vyčíslením rovnice, uváděním tzv. stechiometrických koeficientů (píší se jako přirozená čísla před vzorce či značky prvků, 1 se neuvádí).
\mathrm{2\,C + O_2 \longrightarrow 2\,CO}
Rovnice výše je vyrovnaná tak, aby se ve výchozích látkách i produktech nacházely dva atomy C a dva atomy O: Dva mol („díly“) uhlíku reagují s kyslíkem, vznikají dva mol oxidu uhelnatého.
Reakce podle přijatého/vydaného tepla
Podle přijatého/vydaného tepla se reakce dělí na exotermické (teplo se uvolňuje) a endotermické (teplo se spotřebovává).
Ovlivňování rychlosti reakcí
Rychlost reakce ovlivňují následující faktory (čím větší míra faktoru, tím zpravidla rychlejší reakce):
- koncentrace výchozích látek
- teplota
- velikost povrchu reaktantů
- přítomnost katalyzátorů
Katalyzátory jsou látky, které urychlují chemické reakce. Snižují aktivační energii a tvořením meziproduktů „vedou“ reakci jinou cestou. Vystupují z reakce v původní podobě. Katalyzátory se typicky využívají ve spojení se spalovacími motory, snižují množství vypouštěných jedovatých látek. V živých organismech jako katalyzátory fungují enzymy.
NahoruVyčíslování chemických rovnic
Při chemických reakcích z výchozích látek vznikají produkty. Chemické reakce se popisují chemickými rovnicemi.
Zákon zachování hmotnosti
V rámci chemických reakcí dochází ke změnám chemických vazeb mezi částicemi (atomy/ionty). Částice samotné se ale nemění, jen se jinak přeskupí a navzájem navážou. Platí tedy zákon zachování hmotnosti: počet a typ částic v rámci výchozích látek odpovídá počtu a typu částic v produktech. Stejně tak hmotnost výchozích látek odpovídá hmotnosti produktů.
Vyčíslování rovnic
Mějme rovnici: \mathrm{Fe + O_2 \longrightarrow Fe_2O_3}
| Počet částic ve výchozích látkách | Počet částic v produktech |
|---|---|
| 1 atom železa (\mathrm{Fe}) 2 atomy kyslíku (\mathrm{O}) |
2 atomy železa (\mathrm{Fe}) 3 atomy kyslíku (\mathrm{O}) |
Zákon zachování hmotnosti výše není dodržen, rovnici je potřeba vyrovnat (vyčíslit) tak, aby si počty částic ve výchozích látkách a produktech odpovídaly. To se provede přidáním tzv. stechiometrických koeficientů. Stechiometrické koeficienty jsou čísla, která se píší před vzorce určitých látek v reakci. Popisují, v jakém poměru spolu určité látky reagují (co se týče látkového množství, nebo zkrátka počtu molekul/atomů). Je-li koeficient 1, obvykle se nepíše.
Vyrovnaná rovnice bude vypadat takto: \mathrm{4\;Fe + 3\;O_2 \longrightarrow 2\;Fe_2O_3}
| Počet částic ve výchozích látkách | Počet částic v produktech |
|---|---|
| 4 atomy železa (\mathrm{Fe}) 6 atomů kyslíku (\mathrm{O}) |
4 atomy železa (\mathrm{Fe}) 6 atomů kyslíku (\mathrm{O}) |
Rovnici je pak možné přečíst takto: 4 mol („díly“) železa reagují se 3 mol dvouatomových molekul kyslíku, vznikají 2 mol oxidu železitého.
Při vyrovnávání rovnic nezasahujeme do vzorců
Při vyrovnávání rovnic nelze upravovat samotné vzorců látek. Mohlo by tak dojít ke změně na vzorec zcela jiné (či nereálné) látky. Např. ze vzorce oxidu železitého výše nelze udělat vzorec neexistujícího „oxidu železičitého“ ().
Jak vyčíslovat rovnice
Při vyčíslování neredoxních rovnic je nutné postupně vyrovnávat množství jednotlivých prvků, případně si sestavit soustavu matematických rovnic.
Při vyčíslování redoxních rovnic lze vycházet z toho, že se mezi atomy myšleně přesune určité množství elektronů. Mějme nevyčíslenou reakci:
\mathrm{\overset{0}{P} + {H}\overset{V}{I}{O_3} + H_2O \longrightarrow {H_3}\overset{V}{P}{O_4} + H\overset{-I}{I}}
V rámci ní probíhají následující poloreakce. Aby bylo zajištěno zachování náboje, použijeme křížové pravidlo:
|
oxidace: \mathrm{\overset{0}{P} \longrightarrow \overset{V}{P} … 5\,e^-} redukce: \mathrm{\overset{V}{I} \longrightarrow \overset{-I}{I} … 6\,e^-} |
⤨ |
\overset{\phantom{I}}{6} \overset{\phantom{I}}{5} |
Získaná čísla zapíšeme před látky obsahující daný prvek: \mathrm{6\,P + 5\,HIO_3 + H_2O \longrightarrow 6\,H_3PO_4 + 5\,HI}
Nakonec rovnici dovyčíslíme, v tomto případě přidáním koeficientu ke vzorci vody: \mathrm{6\,P + 5\,HIO_3 + 9\,H_2O \longrightarrow 6\,H_3PO_4 + 5\,HI}
NahoruRedoxní reakce
Při oxidačně-redukčních (redoxních) reakcích dochází ke změnám oxidačních čísel atomů.
Oxidační číslo
Oxidační číslo je formální (myšlený) náboj, který by částice měla, kdyby se všechny elektrony účastnící se jejích vazeb přiřadily elektronegativnějšímu atomu. Oxidační číslo se zapisuje římskou číslicí jako horní index za (či nad) značku prvku, běžně nabývá hodnot od \mathrm{−IV} do \mathrm{VIII}. Elektricky neutrální částice samostatného prvku mají oxidační číslo \mathrm{0} (vzhledem ke stejné elektronegativitě jsou elektrony rovnoměrně rozděleny).
\mathrm{\overset{\scriptsize -IV}{C} \overset{\scriptsize I}{H_4}} – Atom uhlíku (\mathrm{C}) v methanu má oxidační číslo \mathrm{-IV}, atomy vodíku \mathrm{I}.
\mathrm{\overset{\scriptsize IV}{C} \overset{\scriptsize -II}{O_2}} – Atom uhlíku (\mathrm{C}) v oxidu uhličitém má oxidační číslo \mathrm{IV}, atomy kyslíku \mathrm{-II}.
\mathrm{\overset{\scriptsize 0}{O_2}} – Atomy kyslíku (\mathrm{O}) jakožto samostatného prvku mají oxidační číslo \mathrm{0}.
Jinými slovy: čím více (záporně nabitých) elektronů k atomu formálně přiřadíme, tím menší má oxidační číslo.
Oxidační čísla a názvosloví
Oxidační čísla souvisejí s tím, v jakém vzájemném poměru se prvky (atomy) vyskytují v určitých molekulách. Koncovky vyjadřující oxidační čísla atomů se zahrnují např. do názvů halogenidů, oxidů a dalších sloučenin.
Oxidace a redukce
Při oxidaci se oxidační číslo zvětšuje, dochází k myšlenému odevzdávání elektronů (myšlený náboj se stává „více kladným“). Při redukci se oxidační číslo zmenšuje, dochází k myšlenému přijímání elektronů (myšlený náboj se stává „více záporným“).
Oxidace a redukce probíhají současně: zatímco jedna částice elektrony formálně odevzdá, jiná je musí formálně přijmout.
\mathrm{2\,\overset{\scriptsize 0}{Fe} + 3\,\overset{\scriptsize 0}{O_2} \longrightarrow 2\,\overset{\scriptsize III}{Fe_2} \overset{\scriptsize -II}{O_3}}
V rámci reakce výše probíhají tyto poloreakce:
\mathrm{\overset{\scriptsize 0}{Fe} ⟶ \overset{\scriptsize III}{Fe}} – Železo se oxiduje ze stavu \mathrm{0} do stavu \mathrm{III}.
\mathrm{\overset{\scriptsize 0}{O} ⟶ \overset{\scriptsize -II}{O}} – Kyslík se redukuje ze stavu \mathrm{0} do stavu \mathrm{−II}.
Oxidační a redukční činidla
- Jako oxidační činidlo se označuje látka, která oxiduje jiné látky, sama se redukuje (typicky např. kyslík, manganistan draselný, chlor).
- Redukční činidlo redukuje jinou látku, samo se oxiduje (např. vodík a jeho sloučeniny, alkalické kovy, oxid uhelnatý).
Elektrochemie
Elektrochemie se zabývá ději, které se odehrávají na rozhraní elektrod a roztoku (elektrolytu), který obsahuje ionty a tak je schopen vést elektrický proud (zpravidla se jedná o vodný roztok či taveninu).
Elektrody
Elektrody bývají zhotovené z vodivého materiálu (kovů, polokovů či grafitu). Rozlišuje se:
- anoda – Probíhá na ní oxidace.
- katoda – Probíhá na ní redukce.
Elektrolýza
Elektrolýza je děj, při kterém působením stejnosměrného proudu dochází k chemickým změnám na elektrodách. Konkrétní děje ilustruje příklad elektrolýzy vodného roztoku \mathrm{CuCl_2}:
| Elektroda | Náboj (v případě elektrolýzy) | Probíhající děj | Reakce |
|---|---|---|---|
| katoda | záporný | redukce | \mathrm{Cu^{2+} + 2\,e^- \longrightarrow Cu^0} |
| anoda | kladný | oxidace | \mathrm{2\,Cl^– - 2\,e^- \longrightarrow Cl_2^0} |
Elektrolýza se často využívá k rozkladu výchozích látek a výrobě látek samostatných: např. sodíku, hliníku, chloru či čistého kyslíku pro využití v lékařství.
Galvanické články
Galvanický článek je zdrojem stejnosměrného proudu. Ten vzniká na základě redoxních reakcí na elektrodách (dochází k přesunu elektronů mezi látkami). Mezi běžné typy galvanických článků („baterií“) patří např. alkalický článek:
| Elektroda | Náboj (v případě galvanického článku) | Probíhající děj | Materiál |
|---|---|---|---|
| katoda | kladný | redukce | \mathrm{MnO_2} |
| anoda | záporný | oxidace | \mathrm{Zn} v roztoku \mathrm{KOH} |
Celková reakce při vybíjení alkalického článku: \mathrm{Zn + 2\,MnO_2 \longrightarrow ZnO + Mn_2O_3}.
Akumulátory lze opakovaně nabíjet a vybíjet, příkladem je lithium-iontový akumulátor (Li-ion) používaný např. v noteboocích, smartphonech či elektromobilech.
Co je „baterie“?
V úzkém pojetí se za baterii považují sériově zapojené galvanické články. Běžně se toto označení však používá i pro jednotlivé články a akumulátory („nabíjecí baterie“).
Kyselost a zásaditost roztoků, pH
Kyselost/zásaditost roztoků
Míra kyselosti či zásaditosti roztoku se vyjadřuje pomocí pH:
- Roztoky, které mají pH 7, jsou neutrální, např. destilovaná voda.
- Roztoky s pH menším než 7 jsou kyselé, např. citronová šťáva, ocet.
- Roztoky s pH větším než 7 jsou zásadité, např. roztok hydroxidu.
Pro výpočet pH zjednodušeně platí vztah \mathrm{pH = -log[H^+]}, kde \mathrm{[H^+]} je koncentrace kationtů vodíku. Čím více iontů \mathrm{H^+} (respektive \mathrm{H_3O^+}) roztok obsahuje, tím je kyselejší. Koncentrace \mathrm{H^+} a tedy i pH jsou závislé na teplotě. Běžné hodnoty pH jsou od 0 do 14.
Zjišťování pH
Orientačně měřit pH lze pomocí acidobazických indikátorů (např. fenolftalein – a, lakmus). To jsou látky, které mění své zbarvení v závislosti na pH. Indikátory jsou součástí univerzálních indikátorových papírků (b). Přesně lze pH změřit instrumentálně pomocí pH metrů (c), ty často využívají skleněnou elektrodu.



Praktický význam pH
Mnohé skutečnosti bezprostředně ovlivňující člověka jsou spojeny s pH:
- Tělní tekutiny (např. krev, sliny) mají pH v určitém rozsahu, jinak by nemohly plnit svoji funkci.
- V souvislosti se životním prostředím jsou problémem např. kyselé deště či pozvolné okyselování oceánů vlivem stoupající koncentrace \mathrm{CO_2}.
- Konkrétní hodnotu pH je mnohdy nutné dodržovat při určitých technologických postupech, např. při výrobě potravin.
- Půdní roztok se vyznačuje určitým pH, což ovlivňuje pěstování rostlin (včetně zemědělských plodin).
- Hodnota pH ovlivňuje různé další organismy: např. to, zda se v akváriu bude dařit chovaným rybám, nebo zda se v bazénu budou množit sinice a řasy.
Látkové množství, molární hmotnost
Látkové množství
Látkové množství obvykle přeneseně vyjadřuje počet částic (atomů, iontů, molekul). Značí se n, jeho jednotka je \mathrm{mol}.
\mathrm{1\;mol} látky obsahuje přesně 6{,}022\,140\,76 \cdot 10^{23} částic. Toto číslo se označuje jako Avogadrova konstanta, značí se N_A.
Platí tedy vztah n = \frac{N}{N_A}, kde n je látkové množství, N_A je Avogadrova konstanta a N je skutečný počet částic.
Příklad
Jakému látkovému množství odpovídá 3{,}011 \cdot 10^{23} atomů zlata?
Látkové množství (n) spočítáme tak, že zjistíme podíl reálného počtu částic (3{,}011 \cdot 10^{23}) a počtu částic v jednom mol látky (6{,}022 \cdot 10^{23}). Dosadíme: n = \frac{N}{N_A} = \frac{3{,}011 \cdot 10^{23}}{6{,}022 \cdot 10^{23}} = 0{,}5. Látkové množství atomů zlata je 0,5 mol.
Molární hmotnost
Molární hmotnost (M, jednotka \mathrm{g/mol}) vyjadřuje hmotnost určitého látkového množství látky. Molární hmotnost lze spočítat na základě relativních atomových hmotností uvedených v periodické tabulce.
Tedy například molární hmotnost dvouatomové molekuly kyslíku (A_r = 16{,}00) se spočte takto: M_{\mathrm{O_2}} = 2 \cdot 16 = 32\;\mathrm{g/mol}.
Výpočty na základě látkového množství a molární hmotnosti
Na základě látkového množství a molární hmotnosti látky lze spočítat hmotnost (m) dle vztahu m = n \cdot M. Naopak látkové množství je možné spočítat na základě hmotnosti a molární hmotnosti: n = \frac{m}{M}.
Koncept látkového množství je tedy užitečný např. pro zjišťování množství látek v rámci chemických reakcí. Například při rozkladu vody na vodík a kyslík (\mathrm{2\;H_2O \longrightarrow 2\;H_2 + O_2}) ze 2 mol vody vznikají 2 mol dvouatomových molekul vodíku. Tyto látky mají odpovídající látkové množství, ale budou se lišit svou hmotností.
NahoruVýpočty z chemických rovnic
Z chemických rovnic lze vypočítat např. látkové množství či hmotnost jednotlivých zúčastněných látek. Je nutné ovládat výpočty spojené s látkovým množstvím.
Při výpočtech z rovnic je potřeba vycházet ze stechiometrických koeficientů. Např. v rámci reakce \mathrm{2\;H_2 + O_2 \longrightarrow 2\;H_2O} ze 2 mol vodíku a 1 mol kyslíku vznikají 2 mol vody. Pokud by měly vzniknout 4 mol vody (dvakrát tolik), bylo by potřeba 4 mol vodíku a 2 mol kyslíku.
Reagující látky si (s přihlédnutím ke stechiometrickým koeficientům) odpovídají svým látkovým množstvím. Tedy např. ke vzniku 18 g vody (n = 1\;{\mathrm{mol}}; M = 18\;\mathrm{g/mol}) by bylo potřeba 2 g vodíku (n = 1\;{\mathrm{mol}}; M = 2\;\mathrm{g/mol}) a 16 g kyslíku (n = 0{,}5\;{\mathrm{mol}}; M = 32\;\mathrm{g/mol}).
NahoruLátková koncentrace
Látková koncentrace je veličina popisující látkové množství v určitém objemu látky (obvykle roztoku). Značí se c, obvykle užívanou jednotkou je \mathrm{mol/dm^3} (v jednotkách SI pak \mathrm{mol/m^3}).
Čím je roztok koncentrovanější, tím více určité složky obsahuje (respektive tím obsahuje větší látkové množství této složky).
Látková koncentrace se spočítá podle vztahu c = \frac{n}{V}, kde n je látkové množství v \mathrm{mol} a V je celkový objem v \mathrm{dm^3}.
NahoruHmotnostní zlomek
Hmotnostní zlomek vyjadřuje podíl hmotnosti části ve vztahu k celku, obvykle se používá při vyjadřování složení směsí. Je to bezrozměrná veličina. Značí se w. Nabývá hodnoty od 0 do 1, často se vyjadřuje v procentech (též hmotnostní procento).
Hmotnostní zlomek (w) lze vypočítat takto: w = \frac{m}{m_c}, kde m je hmotnost části (určité látky) a m_c je hmotnost celé směsi.
Příklad: známe hmotnost části a hmotnost celé směsi
150 g jogurtu obsahuje 7,5 g bílkovin. Jaký je hmotnostní zlomek bílkovin v jogurtu?
Konkrétní část směsi, tedy bílkoviny (m), váží 7,5 g. Celá směs, tedy jogurt (m_c), váží 150 g. Na základě těchto hodnot spočítáme hmotnostní zlomek: w = \frac{m}{m_c} = \frac{7{,}5\,\mathrm{g}}{150\,\mathrm{g}} = 0{,}05. V jogurtu je tedy \frac{5}{100} neboli 5 % bílkovin, jinými slovy 5 % hmotnosti jogurtu je tvořeno bílkovinami.
Vztah pro hmotnostní zlomek je samozřejmě možné upravit a spočítat tak:
- hmotnost části směsi (na základě znalosti hmotnostního zlomku a celkové hmotnosti): m = w \cdot m_c
- hmotnost celé směsi (na základě znalosti hmotnosti části a hmotnostního zlomku): m_c = \frac{m}{w}
Hmotnostní zlomek se mnohdy počítá pro roztoky tvořené určitou látkou a rozpouštědlem. Celková hmotnost směsi (m_c) je v takovém případě součtem hmotnosti látky a hmotnosti rozpouštědla: w = \frac{m}{m_c} = \frac{m_\mathrm{látka}}{m_\mathrm{látka} + m_\mathrm{rozpouštědlo}}
Příklad: známe hmotnost části a hmotnost rozpouštědla
10 g soli jsme rozpustili v 90 g vody. Jaký je hmotnostní zlomek soli ve vodě?
Rozpuštěná látka má hmotnost 10 g, celková hmotnost roztoku je součtem hmotnosti rozpuštěné látky (soli) a rozpouštědla (vody), tedy: w = \frac{m}{m_c} = \frac{m_\mathrm{soli}}{m_\mathrm{soli} + m_\mathrm{vody}} = \frac{10\,\mathrm{g}}{10\,\mathrm{g} + 90\,\mathrm{g}} = \frac{10\,\mathrm{g}}{100\,\mathrm{g}} = 0{,}1. Hmotnostní zlomek soli ve vodě je 0,1.
Výpočty hmotnostního zlomku jsou v podstatě obdobné výpočtům s procenty. Mj. je dobré si uvědomit, že hmotnost části směsi je vždy menší než hmotnost celé směsi – jinými slovy část směsi nemůže tvořit více než 100 % její hmotnosti (např. 100 g medu z principu nemůže obsahovat 110 g cukru).
NahoruVýpočty z chemických vzorců
Hmotnostní zlomek prvku ve sloučenině lze spočítat jako poměr molární hmotnosti tohoto prvku ku molární hmotnosti celé molekuly (sloučeniny): w_{\mathrm{prvku}}=\frac{a{\cdot}M_{\mathrm{prvku}}}{M_{\mathrm{sloučeniny}}} (a je počet atomů daného prvku).
Například relativní atomová hmotnost vodíku je 1,01, relativní atomová hmotnost kyslíku 16,00. Hmotnostní zlomek vodíku ve vodě (\mathrm{H_2O}) se spočítá jako \frac{2 \cdot 1,01}{2 \cdot 1,01 + 16{,}00} = 0{,}11.
NahoruSkupiny chemických látek
Chemické látky/sloučeniny se dělí do určitých skupin. Může jít o samostatné prvky. Chemické sloučeniny se pak rozdělují podle toho, které prvky ve svých molekulách obsahují, případně jak jsou tyto prvky navzájem navázané.
Sloučeniny lze v základu rozdělit na anorganické a organické (ty zahrnují složitější sloučeniny uhlíku – \mathrm{C}). Základní přehled ve skupinách látek je užitečný třeba při rozebírání chemických látek podle určitého tématu, například si lze uvědomit souvislost vlastností látky s jejím chemickým složením.
Následující soupis obsahuje skupiny látek, jejichž rozlišování je procvičováno v rámci tohoto tématu. Zároveň obsahuje odkazy na jiná témata – vždy věnovaná jen konkrétní skupině.
Anorganické sloučeniny
- halogenidy – Sloučeniny halogenů (prvků 17. skupiny) a elektropozitivnějších prvků, např. chlorid sodný (\mathrm{NaCl}).
- oxidy – Sloučeniny kyslíku s dalšími prvky, např. oxid uhličitý (\mathrm{CO_2}).
- anorganické kyseliny – Látky schopné odštěpovat kation vodíku (\mathrm{H^+}), např. kyselina sírová (\mathrm{H_2SO_4}).
- hydroxidy – Látky zásaditého charakteru, jsou schopné přijímat kation vodíku. Obsahují hydroxidovou skupinu (\mathrm{OH^-}). Příkladem je hydroxid sodný (\mathrm{NaOH}).
- anorganické soli – Vznikají například reakcí kyselin a hydroxidů. Atom vodíku (který byl v původní molekule kyseliny) je obvykle nahrazen atomem kovu. Příkladem je uhličitan vápenatý (\mathrm{CaCO_3}).
Organické sloučeniny
- uhlovodíky – Sloučeniny uhlíku a vodíku, například ethan (\mathrm{C_2H_6}).
- deriváty uhlovodíků – Látky vycházející z uhlovodíků, kde atom či atomy vodíku byly nahrazeny jinými atomy či skupinami. Patří sem halogenderiváty uhlovodíků, alkoholy, aldehydy a ketony nebo karboxylové kyseliny (např. kyselina octová – \mathrm{CH_3COOH}).
Periodická tabulka prvků
Periodická tabulka prvků (také periodická soustava) uspořádává chemické prvky podle vzrůstajícího protonového čísla jejich atomů. Prvky jsou utříděné podle svých opakujících se vlastností, z tabulky je možné vyčíst mnoho informací o nich (značku, název, hodnotu elektronegativity apod.).
- Základem je orientace v periodické tabulce: tušit, kde se zhruba nachází který prvek a umět vyčíst informace o něm.
- Při řešení úloh v chemii a přemýšlení o ní je dobré znát aspoň základní značky prvků.
Musím se učit periodickou tabulku nazpaměť?
Značky nejčastějších prvků si člověk zapamatuje víceméně tím, že s nimi aktivně pracuje a opakovaně se s nimi setkává. Další informace lze v tabulce snadno dohledat. Učit se celou periodickou tabulku nazpaměť je v současné době dobré leda pro trénování paměti.
Na druhou stranu, alespoň značky nejběžnějších prvků je výhodné znát (např. nechceme opakovaně tápat nad tím, že \mathrm{C} je uhlík, \mathrm{O} kyslík, \mathrm{N} dusík nebo \mathrm{H} vodík). K procvičení těchto nejběžnějších prvků slouží lehké úrovně cvičení v této kapitole (např. otázky).
- Znalost nejběžnějších prvků je možné procvičovat i podle jejich popisu.
Orientace v periodické tabulce
Periodická tabulka prvků uspořádává prvky podle vzrůstajícího protonového čísla jejich atomů. Řádky periodické tabulky se označují jako periody, sloupce jako skupiny. V rámci skupin se obvykle u prvků opakují určité vlastnosti.
Z periodické tabulky lze obvykle vyčíst značku prvku, jeho protonové číslo, název (v češtině/latině), elektronegativitu či relativní atomovou hmotnost. Též bývá znázorněno skupenství prvku za standardních podmínek. Některé periodické tabulky též uvádějí typická oxidační čísla.
Seskupení prvků
Prvky se rozdělují na kovy, polokovy a nekovy.
- Kovy dobře vedou elektrický proud a teplo, jsou lesklé, kujné, tažné. Mají nízkou elektronegativitu.
- Nekovy jsou obvykle nevodivé, mají vysokou elektronegativitu, nacházejí se v pravé části PTP.
- Polokovy mají vlastnosti na pomezí kovů a nekovů.
Určité skupiny prvků mají zvláštní názvy:
| Skupina | Název skupiny |
|---|---|
| 1. (mimo Hvodík) | alkalické kovy |
| 2. | kovy alkalických zemin* |
| 15. | pniktogeny |
| 16. | chalkogeny |
| 17. | halogeny |
| 18. | vzácné (ušlechtilé) plyny |
* V českém prostředí mnohdy mimo Beberyllium a Mghořčík.
Tabulka k využití
Při procvičování tohoto tématu se hodí mít „při ruce“ periodickou tabulku k vyhledávání informací.
Prvky: značky
Chemické prvky se popisují určitými značkami. Ty vycházejí z jejich latinských názvů. Značky jsou jedno- či dvoupísmenné (první písmeno je vždy velké, druhé malé). Mezi prvky, s nimiž se člověk často setká (nebo je důraznějším způsobem využívá), patří například:
| Značka | Název prvku |
|---|---|
| H | vodík |
| He | helium |
| Li | lithium |
| C | uhlík |
| Ca | vápník |
| N | dusík |
| O | kyslík |
| F | fluor |
| Na | sodík |
| Mg | hořčík |
| Al | hliník |
| Si | křemík |
| P | fosfor |
| S | síra |
| Cl | chlor |
| K | draslík |
| Fe | železo |
| Zn | zinek |
| Au | zlato |
| I | jod |
| U | uran |
Poznávání prvků si můžete též procvičit podle popisu. Informace o tom, co to vlastně prvek je a z čeho se skládá, jsou obsaženy v kapitole atom, prvky.
NahoruKyslík, vodík
Kyslík
Kyslík se v zemské atmosféře vyskytuje zejména ve formě dvouatomových molekul (\mathrm{O_2}). Tvoří 21 % objemu suchého vzduchu. Je reaktivní, podporuje hoření. Je potřeba pro buněčné dýchání. Samostatný kyslík v atmosféře vznikl zejména díky fotosyntéze. Kyslík se používá např. pro řezání či sváření kovů, jako oxidační činidlo v raketových motorech či pro dýchací přístroje/masky v nemocnicích, v letadlech či při potápění.
Kyslík: hybatel i ničitel (života)
Při buněčném dýchání se uvolňuje energie využívaná k životu podobně jako při hoření, ovšem kontrolovaným způsobem prostřednictvím přesných metabolických drah. Chemická nerovnováha (přítomnost kyslíku jako samostatného prvku) na Zemi tedy umožňuje fungování života. Kyslík ovšem, vzhledem ke své reaktivitě, živé soustavy také pozvolna narušuje (to se týká zejména tzv. volných radikálů kyslíku). Dalším negativním působením kyslíku je např. koroze různých materiálů, zejména kovů.
Ozon (\mathrm{O_3}) se nachází ve stratosféře (asi 25–35 km nad povrchem Země), při jeho vzniku dochází k absorbování UV záření pocházejícího ze Slunce. V menším množství ozon vzniká např. při úderech blesků (to se podílí na typické „vůni“ bouřky). Negativní vliv na zdraví může mít jakožto přízemní ozon, který mnohdy bývá součástí smogu.
Vodík
Vodík je nejrozšířenější prvek ve vesmíru. Tvoří dvouatomové molekuly \mathrm{H_2}. Je lehčí než vzduch. Reaguje s kyslíkem za vzniku vody. Je zásadní součástí biomolekul. Vyrábí se rozkladem vody stejnosměrným proudem (elektrolýzou) či se získává ze zemního plynu. Využívá se např. ke ztužení tuků (z olejů se připravují pevné tuky, např. při výrobě margarínu), omezeně jako palivo v dopravních prostředcích.
NahoruUžitné kovy
Tato kapitola obsahuje informace o přechodných kovech společně s využívanými kovy z bloku p a je určena zejména pro ZŠ/nižší gymnázium. Samostatnou kapitolu věnovanou přechodným kovům (hlavně pro SŠ/VG) najdete v uzlu prvky dle skupin.
NahoruHalogenidy
Halogenidy jsou sloučeniny halogenů (prvků 17. skupiny: F, Cl, Br, I) s méně elektronegativními prvky, obvykle kovy. Zároveň se jedná o soli bezkyslíkatých kyselin.
Oxidační číslo atomu halogenu v halogenidech je −I.
Název halogenidu sestává z podstatného jména (odpovídá názvu halogenu s koncovkou -id, např. chlorid) a přídavného jména (obsahuje název prvku, se kterým je halogen sloučen, s koncovkou dle jeho oxidačního čísla, např. sodný).
Koncovky přídavného jména spojené s oxidačním číslem jsou obdobné jako u názvosloví dalších sloučenin:
| Koncovka | Oxidační číslo |
|---|---|
| -ný | I |
| -natý | II |
| -itý | III |
| -ičitý | IV |
| -ičný, -ečný | V |
| -ový | VI |
| -istý | VII |
| -ičelý | VIII |
Součet oxidačních čísel v (elektricky neutrální) molekule halogenidu je 0. Počet atomů halogenu tedy odpovídá oxidačnímu číslu druhého prvku.
Tedy např. = bromid hořečnatý.
Mezi další příklady halogenidů patří:
| Vzorec (včetně oxidačních čísel) | Název | Další informace |
|---|---|---|
| \mathrm{\overset{\tiny I}{Na} \overset{\tiny -I}{Cl}} | chlorid sodný | Tvoří sůl kamennou, je to hlavní složka kuchyňské soli. |
| \mathrm{\overset{\tiny II}{Ca} \overset{\tiny -I}{F_2}} | fluorid vápenatý | Tvoří minerál fluorit, zdroj fluoru. |
| \mathrm{\overset{\tiny III}{Al} \overset{\tiny -I}{Br_3}} | bromid hlinitý | Užívá se jako katalyzátor v organické chemii. |
| \mathrm{\overset{\tiny V}{P} \overset{\tiny -I}{Cl_5}} | chlorid fosforečný | Používá se jako chlorační činidlo v organické chemii. |
Oxidy jsou sloučeniny kyslíku s méně elektronegativními prvky. Oxidační číslo atomu kyslíku v oxidech je −II (kyslík myšleně přijímá 2 elektrony od méně elektronegativního atomu).
Názvosloví oxidů
Název oxidu sestává z podstatného jména oxid a přídavného jména (obsahuje název prvku, se kterým je kyslík sloučen, s koncovkou dle jeho oxidačního čísla).
| Oxidační číslo prvku sloučeného s kyslíkem | Koncovka přídavného jména | Příklad |
|---|---|---|
| I | -ný | \mathrm{\overset{\tiny I}{N_2} \overset{\tiny -II}{O}} – oxid dusný |
| II | -natý | \mathrm{\overset{\tiny II}{C} \overset{\tiny -II}{O}} – oxid uhelnatý |
| III | -itý | \mathrm{\overset{\tiny III}{Fe_2} \overset{\tiny -II}{O_3}} – oxid železitý |
| IV | -ičitý | \mathrm{\overset{\tiny IV}{C} \overset{\tiny -II}{O_2}} – oxid uhličitý |
| V | -ičný, -ečný | \mathrm{\overset{\tiny V}{V_2} \overset{\tiny -II}{O_5}} – oxid vanadičný |
| VI | -ový | \mathrm{\overset{\tiny VI}{S} \overset{\tiny -II}{O_3}} – oxid sírový |
| VII | -istý | \mathrm{\overset{\tiny VII}{Cl_2} \overset{\tiny -II}{O_7}} – oxid chloristý |
| VIII | -ičelý | \mathrm{\overset{\tiny VIII}{Os} \overset{\tiny -II}{O_4}} – oxid osmičelý |
Převádění názvu na vzorec
Příklad: oxid selenový.
- Napsat značky prvků. Oxidy vždy obsahují kyslík (\mathrm{O}), který se ve vzorci píše doprava. – \mathrm{SeO}
- Kyslík má oxidační číslo −II. – \mathrm{Se \overset{\tiny -II}{O}}
- Oxidační číslo druhého prvku vychází z koncovky přídavného jména: selenový → selen bude mít oxidační číslo VI. – \mathrm{\overset{\tiny VI}{Se} \overset{\tiny -II}{O}}
- Součet oxidačních čísel v molekule musí být roven 0, je nutné upravit počet jednotlivých atomů.
- Pomocí křížového pravidla: oxidační číslo „převést“ na počet částic druhého prvku (\mathrm{\overset{\tiny VI}{Se_2} \overset{\tiny -II}{O_6}}) a následně vzorec zjednodušit (\mathrm{\overset{\tiny VI}{Se} \overset{\tiny -II}{O_3}}).
- Úvahou/sestavením rovnice. Selen má oxidační číslo VI. Kolik v molekule musí být atomů kyslíku (s ox. č. −II), aby „vyrovnaly“ oxidační číslo VI? Neboli: \mathrm{-II} \cdot x + \mathrm{VI} = 0, x = 3. V molekule musejí být 3 atomy kyslíku: \mathrm{\overset{\tiny VI}{Se} \overset{\tiny -II}{O_3}}.
- Oxidační čísla se obvykle zapisují jen jako pomůcka při tvoření vzorce, tedy výsledný vzorec by byl \mathrm{SeO_3}.
Tento postup přibližuje cvičení krok po kroku (název na vzorec).
Převádění vzorce na název
Příklad: \mathrm{Al_2O_3}.
- Uvědomit si, že jde o oxid.
- Zjistit název prvku sloučeného s kyslíkem (v tomto případě jde o Al = hliník). – oxid hlin…
- Zjistit oxidační číslo druhého prvku. Součet oxidačních čísel v molekule je 0.
- Každý atom kyslíku má oxidační číslo −II, jsou přítomny 3 atomy kyslíku. Součet oxidačních čísel u atomů O je tedy −6.
- Jsou přítomny 2 atomy hliníku (Al). Jaké musí být oxidační číslo každého z nich, aby došlo k „vyrovnání“ −6 u atomů O? Neboli: 2 \cdot x -6 = 0, x = 3. Oxidační číslo hliníku (Al) je III.
- Zjistit, jaké koncovce odpovídá dané oxidační číslo. V tomto případě III → -itý, jedná se o oxid hlinitý.
Tento postup přibližuje cvičení krok po kroku (vzorec na název).
Příklady oxidů
- oxid uhličitý (\mathrm{\overset{\tiny IV}{C} \overset{\tiny -II}{O_2}}) – Je potřeba pro fotosyntézu. Vzniká při buněčném dýchání (vyšší koncentrace v zadýchané místnosti negativně ovlivňuje soustředění), ale také při spalování organických látek/fosilních paliv. Ve vzduchu je ho asi 0,042 % (420 ppm). Jeho obsah ve vzduchu vlivem lidské činnosti stoupá, což prohlubuje skleníkový efekt.
- oxid uhelnatý (\mathrm{\overset{\tiny II}{C} \overset{\tiny -II}{O}}) – Vzniká při hoření za nedostatku kyslíku. Váže se na hemoglobin (červené krevní barvivo) ochotněji než kyslík, čímž zabraňuje přenosu kyslíku v těle (to je podstata jeho jedovatosti).
- oxid dusný (\mathrm{\overset{\tiny I}{N_2} \overset{\tiny -II}{O}}) – „Rajský plyn“, používá se ke znecitlivění ve stomatologii či k přípravě šlehačky.
- další oxidy dusíku – Souhrnně označované jako \mathrm{NO}_x. Jedovaté, vznikají při provozu spalovacích motorů. Jejich přítomnost vede ke vzniku přízemního ozonu.
- oxid křemičitý (\mathrm{\overset{\tiny IV}{Si} \overset{\tiny -II}{O_2}}) – Tvoří minerál křemen, je součástí mnohých hornin (např. žuly). Potřeba pro výrobu skla (ve formě sklářského písku). Jeho pórovitá forma, silikagel, se používá k pohlcování vlhkosti (typicky v malých sáčcích u různých výrobků).
- oxid titaničitý (\mathrm{\overset{\tiny IV}{Ti} \overset{\tiny -II}{O_2}}) – Využíván jako bílé barvivo, např. do temper či zubních past.
- oxid siřičitý (\mathrm{\overset{\tiny IV}{S} \overset{\tiny -II}{O_2}}) – Jedovatý. Vzniká při spalování paliv obsahujících síru (např. hnědého uhlí). Dříve způsoboval kyselé deště, nyní se zachytává při odsiřování spalin. V nízkých koncentracích se používá jako konzervant (např. u sušeného ovoce).
- oxid sírový (\mathrm{\overset{\tiny VI}{S} \overset{\tiny -II}{O_3}}) – Jeho reakcí s vodou vzniká kyselina sírová.
- oxid železitý (\mathrm{\overset{\tiny III}{Fe_2} \overset{\tiny -II}{O_3}}) – Součástí minerálu hematitu, ruda železa.
- oxid vápenatý (\mathrm{\overset{\tiny II}{Ca} \overset{\tiny -II}{O}}) – Pálené vápno, součást cementu. Vzniká pálením vápence.
Sulfidy jsou sloučeniny síry s méně elektronegativními prvky. Oxidační číslo atomu síry v sulfidech je −II.
Název sulfidu sestává z podstatného jména sulfid a přídavného jména (obsahuje název prvku, se kterým je síra sloučena, s koncovkou dle jeho oxidačního čísla). Názvosloví sulfidů je prakticky totožné s názvoslovím oxidů.
Pro ilustraci je dále uvedeno několik příkladů sulfidů:
| Vzorec (včetně oxidačních čísel) | Název |
|---|---|
| \mathrm{\overset{\tiny II}{Pb} \overset{\tiny -II}{S}} | sulfid olovnatý |
| \mathrm{\overset{\tiny III}{Al_2} \overset{\tiny -II}{S_3}} | sulfid hlinitý |
Kyseliny a hydroxidy

Anorganické kyseliny
Anorganické kyseliny se rozdělují na bezkyslíkaté (např. kyselina chlorovodíková – \mathrm{HCl}) a kyslíkaté (obsahují v molekulách atomy kyslíku). Vzorce kyslíkatých kyselin lze odvodit reakcí oxidu příslušného oxidačního čísla s vodou, například:
\mathrm{SO_2 + H_2O \longrightarrow H_2SO_3} – Oxid siřičitý reaguje s vodou, vzniká kyselina siřičitá.
Mezi anorganické kyseliny patří například:
| Název kyseliny | Vzorec | Informace |
|---|---|---|
| kyselina chlorovodíková | \mathrm{HCl} | Bezkyslíkatá kyselina, je součástí žaludečních šťáv (ničí mikroorganismy, umožňuje funkci enzymů). Technická se též označuje jako kyselina solná. |
| kyselina sírová | \mathrm{H_2SO_4} | Má široké využití v průmyslu, např. při výrobě plastů, léčiv, výbušnin, hnojiv. |
| kyselina dusičná | \mathrm{HNO_3} | Má široké využití v průmyslu, např. při výrobě hnojiv a výbušnin. |
| kyselina uhličitá | \mathrm{H_2CO_3} | Vzniká rozpouštěním oxidu uhličitého ve vodě, je obsažena např. v sycených nápojích. V přírodě může rozpouštět uhličitan vápenatý a podílet se tak na vzniku krasových jevů. |
| kyselina chlorná | \mathrm{HClO} | Je součástí čisticích a dezinfekčních prostředků. V malé koncentraci bývá používána pro dezinfekci bazénů. |
Hydroxidy
Hydroxidy (≐ zásady) ve svých molekulách obvykle obsahují hydroxidový anion (\mathrm{OH^-}), který uvolňují. Jejich názvy sestávají z podstatného jména hydroxid a přídavného jména obsahujícího název prvku sloučeného s hydroxidovou skupinou s koncovkou dle oxidačního čísla. Například \mathrm{\overset{\tiny I}{Na} \overset{\tiny -I}{OH}} je hydroxid sodný (používá se např. k čištění odpadu u umyvadla či dřezu), \mathrm{\overset{\tiny II}{Ca} \overset{\tiny -I}{(OH)_2}} hydroxid vápenatý (hašené vápno, vzniká reakcí páleného vápna s vodou).
Zásaditý je i roztok amoniaku (\mathrm{NH_3}) používaný např. jako chladicí médium či k syntéze různých látek obsahujících dusík (např. kyseliny dusičné, hnojiv). Amoniak se získává katalyzovanou reakcí dusíku s vodíkem (Haberův–Boschův proces): \mathrm{N_2 + 3\,H_2 \longrightarrow 2\,NH_3}
První pomoc
První pomocí při zasažení těla kyselinou či hydroxidem je vymývání postiženého místa vodou.
Související kapitoly
- Kyselost a zásaditost roztoků, pH – Obecné informace o pH a jeho měření.
- Karboxylové kyseliny – Kyseliny náležící do tématu organické chemie.
Soli jsou sloučeniny iontového charakteru. Obvykle se jedná o pevné látky s krystalickou strukturou, které v tavenině vedou elektrický proud. Zpravidla jsou rozpustné ve vodě (v polárních rozpouštědlech). Vznikají například neutralizací, tedy reakcí kyseliny a hydroxidu.
Bezkyslíkaté soli
Bezkyslíkaté soli odpovídají halogenidům či sulfidům.
Soli kyslíkatých kyselin
Název solí kyslíkatých kyselin se skládá z podstatného jména (to se týká aniontu pocházejícího z kyslíkaté kyseliny) a přídavného jména (týká se kationtu, obvykle iontu kovu). Například = dusičnan draselný.
| Oxidační číslo kyselinotvorného prvku | Příklad podstatného jména/aniontu |
|---|---|
| I | chlornan \mathrm{(ClO)^{-I}} |
| III | dusitan \mathrm{(NO_2)^{-I}} |
| IV | uhličitan \mathrm{(CO_3)^{-II}}, siřičitan \mathrm{(SO_3)^{-II}}, křemičitan \mathrm{(SiO_3)^{-II}} |
| V | dusičnan \mathrm{(NO_3)^{-I}}, trihydrogenfosforečnan = fosforečnan \mathrm{(PO_4)^{-III}}, chlorečnan \mathrm{(ClO_3)^{-I}} |
| VI | síran \mathrm{(SO_4)^{-II}} |
| VII | manganistan \mathrm{(MnO_4)^{-I}} |
Převádění názvu na vzorec
Příklad: dusičnan manganatý
- Nejprve vytvoříme část vzorce odpovídající aniontu (je nutné ovládat tvoření vzorců kyslíkatých kyselin, nebo si základní kyseliny pamatovat – vizte výše). Dusičnan → bude se jednat o kyselinu dusičnou \mathrm{HNO_3}.
- Anion kyseliny vzniká tak, že kyselina odštěpí kationt(y) vodíku. Bude mít tedy podobu \mathrm{(NO_3)^{-I}}.
- Přidáme prvek tvořící kation s patřičným oxidačním číslem, v tomto případě \mathrm{Mn} s oxidačním číslem II (-natý). \mathrm{Mn^{II}(NO_3)^{-I}}.
- Součet oxidačních čísel – respektive (myšlených) nábojů – v elektricky neutrální molekule je 0. S ohledem na to upravíme počet iontů. Lze použít i křížové pravidlo a oxidační číslo jednoho iontu „převést“ na počet výskytů druhého iontu: \mathrm{Mn^{II}(NO_3)^{-I}_{2}} → \mathrm{Mn(NO_3)_{2}}
Převádění vzorce na název
Příklad: \mathrm{Al_2(SO_4)_3}
- Při převádění vzorce na název je nutné si pamatovat/vyhledat buď podobu aniontů kyselin, nebo typická oxidační čísla částic prvků. Ideální je použít kombinaci obojího.
- Vycházíme-li ze znalosti aniontu:
- Víme, že sůl obsahuje síranový anion, který je odvozený z kyseliny sírové (\mathrm{H_2SO_4}). Tento anion má oxidační číslo −II (vznikne odštěpením dvou iontů \mathrm{H^+}).
- Celkový součet oxidačních čísel síranových aniontů je −6.
- Aby byl součet oxidačních čísel v molekule 0, každá jedna z částic hliníku musí mít oxidační číslo III.
- Vycházíme-li z typických oxidačních čísel (u iontů odpovídají jejich nábojům):
- Hliník (Al) má typické oxidační číslo III. Přídavné jméno bude hlinitý.
- Kyslík (O) se ve sloučeninách typicky vyskytuje v oxidačním čísle −II (pokud není sloučen s fluorem).
- Síra (S) musí tedy mít oxidační číslo VI → podstatné jméno bude síran.
- Sůl vzorce \mathrm{Al_2(SO_4)_3} je síran hlinitý.
Příklady solí kyslíkatých kyselin
- uhličitan vápenatý (\mathrm{CaCO_3}) – Součástí minerálu kalcitu či hornin vápence/mramoru. Tvoří oporné struktury a schránky živočichů a dalších organismů. Součástí vodního kamene.
- uhličitan sodný (\mathrm{Na_2CO_3}) – Soda na praní, změkčovadlo vody. Používá se také např. při výrobě skla či papíru.
- hydrogenuhličitan sodný (\mathrm{NaHCO_3}) – Jedlá soda, např. součástí kypřicích prášků.
- chlornan sodný (\mathrm{NaClO}) – K dezinfekci, bělicí činidlo (např. v Savu či k úpravě vody v bazénech).
- dusitan draselný (\mathrm{KNO_2}) – Používá se jako konzervant v uzeninách.
- pentahydrát síranu měďnatého (\mathrm{CuSO_4 \cdot 5\,H_2O}) – Modrá skalice, sůl typické modré barvy.
- dusičnany (\mathrm{NO_3^-}), fosforečnany (\mathrm{PO_4^{3-}}) – Bývají součástí hnojiv. Jejich uvolňování do životního prostředí vede k eutrofizaci vod, v nichž se pak mohou přemnožit sinice nebo řasy.
Organické soli
Tato kapitola se zabývá hlavně solemi anorganických kyselin. Soli ale mohou mít i organickou podstatu (vizte kapitolu deriváty karboxylových kyselin).
Organická chemie
Organická chemie se zabývá složitějšími sloučeninami uhlíku (\mathrm{C}). Organické látky jsou základem živých organismů, člověk je také široce využívá např. jako fosilní paliva, léčiva či plasty.
- Kapitola úvod do organické chemie přibližuje uhlík jakožto ústřední prvek organických látek, jeho chemické vazby a vzorce sloučenin.
- V kapitole zdroje organických látek lze procvičit informace o fosilních surovinách (ropa, uhlí, zemní plyn), s tím úzce souvisí i pohonné hmoty a doprava.
- Zejména na středoškolské úrovni je dobré mít přehled v pojmech týkajících se organických reakcí.
- Organické látky jdou rozdělit na následující skupiny. V příslušných podkapitolách lze procvičit jak obecné informace a souvislosti, tak názvosloví látek.
- uhlovodíky – Obsahují pouze atomy uhlíku (\mathrm{C}) a vodíku (\mathrm{H}).
- deriváty uhlovodíků – Atomy \mathrm{H} jsou v nich nahrazené jinými atomy či funkčními skupinami. Mezi deriváty uhlovodíků patří např. alkoholy či karboxylové kyseliny.
- Plasty patří mezi organické látky, některé vycházejí z uhlovodíků, některé z jejich derivátů.
- Na organickou chemii navazuje biochemie, ta se zabývá látkami a ději v živých organismech.
Organická chemie obecně
Tato kapitola poskytuje všeobecný počáteční přehled v organické chemii. Obsahuje tyto podkapitoly:
- Úvod do organické chemie – Přibližuje uhlík jakožto základ organických sloučenin, chemické vazby uhlíku a vzorce sloučenin.
- Zdroje organických látek – Věnuje se surovinám, ze kterých se organické látky získávají.
- Reakce v organické chemii, indukční a mezomerní efekt – Pojmy spojené s reakcemi, typy reakcí a jejich ovlivňování navázanými skupinami.
Úvod do organické chemie
Organická chemie se zabývá organickými látkami. To jsou (většinou složitější) sloučeniny, jejichž základem je uhlík (\mathrm{C}), kromě něj obsahují i další prvky (\mathrm{H}, \mathrm{O}, \mathrm{N}, halogeny, \mathrm{S}…).
Výskyt organických sloučenin
Organické sloučeniny jsou zásadní součástí živých organismů, mohou tedy být přírodního původu. Zdrojem organických látek je např. biomasa, ropa, zemní plyn či uhlí. Většina známých organických sloučenin je uměle vyrobena (např. z výše uvedených zdrojů). Z organických látek sestávají třeba léčiva, plasty či pohonné hmoty.
Uhlík jako základ organických sloučenin
Atomy uhlíku mají 4 valenční elektrony, jsou 4vazné. Zároveň ochotně tvoří řetězce či cykly (kruhy), což dává vzniknout obrovskému množství organických sloučenin. Atomy uhlíku mohou tvořit jednoduché, dvojné i trojné vazby.
Vazby atomů C podrobněji
Jednoduchá vazba uhlíku je vazba σ, u té je elektronová hustota nejvyšší na spojnicích jader atomů účastnících se vazby. V případě dvojné vazby jde o vazbu σ a vazbu π (u vazby π se překrývají orbitaly mimo spojnici jader, tato vazba se ochotněji účastní reakcí), trojná vazba sestává z jedné vazby σ a dvou vazeb π.
Atomy uhlíku mají v základním stavu elektronovou konfiguraci \mathrm{[He]\;2s\,\boxed{\uparrow\downarrow} \;2p\,\boxed{\uparrow\;}\,\boxed{\uparrow\;}\,\boxed{\phantom{\uparrow\;}}}. Po excitaci jsou ve valenčních orbitalech k dispozici 4 nespárované elektrony pro tvorbu kovalentních vazeb. U valenčních orbitalů dochází ke sjednocování energií (a tvarů), tzv. hybridizaci:
Při hybridizaci \mathrm{sp^3} se sjednotí všechny valenční orbitaly: \mathrm{[He]}\;\textcolor{#16a085}{2\mathrm{s}\,\boxed{\uparrow\;}\;2\mathrm{p}_{x, y, z}\boxed{\uparrow\; }\,\boxed{\uparrow\;}\,\boxed{\uparrow\;}}. Vznikající (jednoduché) vazby jsou pak rovnocenné a jejich vrcholy tvoří čtyřstěn (tetraedr). Tato hybridizace se vyskytuje např. v molekule methanu:
Při hybridizaci \mathrm{sp^2} je stav orbitalů následující: \mathrm{[He]}\;\textcolor{#16a085}{\mathrm{2s},2\mathrm{p}_x, 2\mathrm{p}_y\,\boxed{\uparrow\;}\,\boxed{\uparrow\;}\,\boxed{\uparrow\;}}\;2\mathrm{p}_{z}\boxed{\uparrow\;}. Vznikají dvě jednoduché vazby a jedna dvojná, jejich vrcholy vytvářejí (rovnostranný) trojúhelník. Tuto hybridizaci má uhlík např. v molekule ethenu:
Hybridizaci \mathrm{sp} lze znázornit takto: \mathrm{[He]}\;\textcolor{#16a085}{\mathrm{2s},2\mathrm{p}_x \,\boxed{\uparrow\;}\,\boxed{\uparrow\;}}\;2\mathrm{p}_y,2\mathrm{p}_{z}\boxed{\uparrow\;}\,\boxed{\uparrow\;}. Dochází ke vzniku jednoduché a trojné vazby, nebo dvou dvojných vazeb. Tvar je lineární. Příkladem je ethyn:
Typy vzorců
Stavbu molekul organických sloučenin vyjadřují zejména následující typy vzorců. Jako příklad je vždy uveden vzorec propan-1-olu.
- strukturní – Znázorňuje konkrétní uspořádání atomů v molekule. Ve vzorci mohou být explicitně zobrazené vazby atomů vodíku (vlevo), značka uhlíku se mnohdy pro zjednodušení vynechává (vpravo):
- racionální – Ukazuje navázání (funkčních) skupin atomů:
- sumární – Udává celkové počty atomů jednotlivých prvků:
Izomerie u organických látek
Látky, které se skládají ze stejných částic (tedy mají stejné sumární vzorce), mohou tyto částice (a vazby mezi nimi) mít různě rozmístěné. Poté se jedná o izomery. Izomery vznikají i u anorganických látek, ale pro organické látky jsou vyloženě typické.
- Konstituční (strukturní) izomery (a) se liší pořadím atomů/vazeb (např. ethanol a dimethylether).
- Konfigurační izomery (stereoizomery) se liší prostorovým uspořádáním atomů:
- Cis/trans izomerie (b) se týká substituentů u dvojných vazeb (např. cis- a trans-but-2-en) nebo na cyklických strukturách. Energeticky výhodnější je trans izomerie, kde se substituenty vzájemně tolik neovlivňují.
- Optická izomerie (c) souvisí s tím, že některé molekuly jsou navzájem svými „zrcadlovými obrazy“. Optické izomery (enantiomery) jinak stáčejí rovinu polarizovaného světla. Asymetrie vzniká na tzv. stereocentrech, což jsou v případě organických sloučenin obvykle asymetrické uhlíky, na něž jsou navázány 4 různé substituenty.
- Konformery (d) se liší pouze rotací součástí molekul kolem jednoduché vazby (např. u ethanu, nezákrytová konformace je energeticky výhodnější) či více jednoduchých vazeb (např. u cyklohexanu).
Zdroje organických látek (ropa, uhlí, zemní plyn)
Mezi zdroje organických látek patří například biomasa, uhlí, ropa či zemní plyn.
Biomasa
Jako biomasa se označuje souhrn látek tvořících živé organismy. Dále uvedené fosilní zdroje organických látek vznikly její přeměnou.
Uhlí
Uhlí vzniklo za nepřístupu vzduchu ze zbytků rostlin, které se hromadily v močálech a jezerních pánvích.
- Černé uhlí pochází zejména z karbonu (to je perioda prvohor), v této době se zdejší území nacházelo na rovníku a rostly zde „lesy“ plavuní, přesliček a kapradin. Černé uhlí se těží hloubkově v ostravsko-karvinské pánvi (v současnosti již jen v dolu ČSM). Z černého uhlí se vyrábí koks pro výrobu železa. Z černouhelného dehtu, což je odpadní produkt výroby koksu, lze získávat zejména aromatické uhlovodíky.
- Hnědé uhlí v Česku pochází z neogénu („mladší třetihory“), vzniklo mj. z jehličnanů a listnatých stromů. Těží se povrchově v mostecké, chebské či sokolovské pánvi. Používá se zejména pro provoz tepelných elektráren.
Ropa
Vznikla z mořských mikroorganismů (řas a živočišného planktonu). V Česku jsou jí pouze malé zásoby. Ropa se dováží do Česka prostřednictvím ropovodu IKL z Německa, ten je pokračováním Transalpine Pipeline (TAL). Ropovod TAL začíná v italském Terstu, sem se dováží ropa tankery hlavně z arabských zemí.
Ropovod Družba
Dovoz ropy z Ruska ropovodem Družba byl značně omezen po invazi na Ukrajinu v roce 2022. Od března 2025 se jím do Česka už ropa už vůbec nedodává.
Ropa se nachází pod vrstvami nepropustných hornin, těží se jak na pevnině, tak na moři. Havárie ropných plošin (ale i tankerů) mají značně negativní vliv na životní prostředí.
Ropa je směs, především z uhlovodíků. Jednotlivé složky ropy se oddělují pomocí frakční destilace (respektive přesněji kontinuální rektifikace) na základě rozdílných teplot varu. Frakční destilací (a případnými dalšími úpravami) se získává např. propan-butan, benzin, petrolej, motorová nafta či asfalt. Z ropy též lze oddělit např. benzen, ethen, propen aj.
Zemní plyn
Zemní plyn obsahuje methan (\mathrm{CH_4}) a další těkavé uhlovodíky s krátkým uhlíkovým řetězcem. Mnohdy doprovází ložiska ropy či uhlí. V Evropě se těží v Norsku, dováží se např. z Ruska, Alžírska, ve formě LNG (zkapalněného zemního plynu) ze Spojených států.
NahoruReakce v organické chemii, indukční a mezomerní efekt
Organické látky podléhají určitým typům reakcí.
Typy reagujících částic a jejich vznik
Pokud je reagující částice elektrofilní, vyhledává záporný náboj a je kladně nabitá (např. \mathrm{NO_2^+}, \mathrm{Br^+}, \mathrm{H_3O^+}). Nukleofilní částice vyhledává kladný náboj a bývá nabitá záporně, případně obsahuje volný elektronový pár (např. \mathrm{Cl^-}, \mathrm{NH_3}). Mnohé elektrofilní či nukleofilní částice vznikají při heterolytickém štěpení vazeb, schematicky \mathrm{AB \longrightarrow A^+ + B^-}.
Radikál je velmi reaktivní částice, má jeden či více nespárovaných elektronů. Radikály vznikají při homolytickém štěpení, schematicky \mathrm{AB \longrightarrow A\!\boldsymbol{\cdot} + B\boldsymbol{\cdot}}.
Typy reakcí
- Adice je navázání (přidání) atomů či skupin do molekuly. Konkrétními příklady jsou hydrogenace (adice vodíku), hydratace (adice vody) či halogenace (adice halogenu). Aby mohla adice proběhnout, musí v molekule být přítomna násobná vazba. Násobnost této vazby se adicí snižuje (zvyšuje se nasycenost).
- Eliminace je odstranění částic z molekuly. Při eliminaci vzniká násobná vazba mezi atomy C či se zvětšuje její násobnost (snižuje se nasycenost).
- Substituce je nahrazení atomu či skupiny jiným atomem/skupinou.
- Izomerace (někdy též přesmyk) je změna uspořádání částic v rámci molekuly, vznikají při ní izomery.
- Oxidace zahrnuje zvyšování oxidačního čísla, v organické chemii obvykle souvisí s přidáním kyslíku a/nebo odebráním vodíku. Redukce souvisí se snižováním oxidačního čísla, obvykle odebráním kyslíku a/nebo přidáním vodíku.
Indukční a mezomerní efekt
Indukční a mezomerní efekt způsobují změnu elektronové hustoty a tím ovlivňují průběh chemických reakcí.
- Indukční efekt souvisí s posunem elektronové hustoty po σ vazbách. Atomy s vysokou elektronegativitou (např. O, F) snižují elektronovou hustotu na sousedních atomech, mají tedy záporný indukční efekt (−I). Naopak atomy s nízkou elektronegativitou (např. Mg, Li) mají indukční efekt kladný (+I), elektronovou hustotu na sousedních atomech zvyšují.
- Mezomerní efekt souvisí s posunem elektronové hustoty u π vazeb (násobných vazeb) a volných elektronových párů. Uplatňuje se např. u substituovaného aromatického jádra. Substituenty snižující hustotu π elektronů v konjugovaném systému mají záporný (−M) mezomerní efekt. Substituenty, které tuto hustotu zvyšují, mají mezomerní efekt kladný (+M).
Uhlovodíky
Uhlovodíky jsou organické sloučeniny obsahující pouze atomy uhlíku (\mathrm{C}) a vodíku (\mathrm{H}). Jsou součástí fosilních surovin (zemního plynu, ropy), používají se např. k výrobě plastů či jako rozpouštědla.
Uhlovodíky se podle typu uhlíkového řetězce rozdělují na:
- alifatické – (Cyklo)alkany/alkeny/alkeny.
- acyklické – Uhlíkový řetězec je lineární (přímý) nebo rozvětvený, patří sem mj. alkany, alkeny a alkyny.
- cyklické – Uhlíkový řetězec je uspořádaný do cyklu (kruhu). Náleží sem cykloalkany, cykloalkeny a cykloalkyny.
- aromatické – Obsahují aromatické jádro – systém delokalizovaných π vazeb (např. benzen).
Vše výše zmíněné najednou nabízí kapitola uhlovodíky: mix.
Tipy k procvičování
Rozhodovačky nabízejí procvičování obecných informací/souvislostí o uhlovodících. Ve cvičeních otázky, překladatel a pexeso lze trénovat názvosloví. Co se názvosloví týče, pro 2. stupeň ZŠ/NG jsou vhodné lehké úrovně cvičení.
Uhlovodíky: (cyklo)alkany/alkeny/alkyny
Uhlovodíky jsou organické sloučeniny obsahující atomy uhlíku (C) a vodíku (H). Tato kapitola se věnuje acyklickým uhlovodíkům (s lineárními či rozvětvenými řetězci) a uhlovodíkům cyklickým (ty mají uhlíkové řetězce uzavřené do kruhu, ale nejsou aromatické).
Názvosloví uhlovodíků v základu využívá kořen slova odpovídající počtu atomů C:
| Počet atomů C | Uhlovodík |
|---|---|
| 1 | methan |
| 2 | ethan |
| 3 | propan |
| 4 | butan |
| 5 | pentan |
| 6 | hexan |
| 7 | heptan |
atd.
Koncovka poté odráží přítomnost určitých vazeb:
| Vazba | Koncovka |
|---|---|
| jednoduchá | -an |
| jedna dvojná | -en |
| jedna trojná | -yn |
Alkany, cykloalkany
V molekulách obsahují jednoduché vazby mezi atomy C. Jejich body varu rostou se stoupající molekulovou hmotností.
- methan (\mathrm{CH_4}) – Nejjednodušší uhlovodík. Hlavní součást zemního plynu, spalováním za účasti kyslíku vzniká jen \mathrm{CO_2} a \mathrm{H_2O}. V přírodě vzniká např. při hnilobných procesech, podílí se na skleníkovém efektu.
- propan (\mathrm{C_3H_8}), butan (\mathrm{C_4H_{10}}) – Směs se používá v tlakových nádobách na vaření, méně často jako palivo (LPG = liquefied petroleum gas).
- cyklohexan (\mathrm{C_6H_{12}}) – Nepolární rozpouštědlo.
Mezi významné reakce těchto látek patří radikálová substituce (vznik radikálů je iniciován např. UV zářením), či dehydrogenace za vzniku násobných vazeb mezi atomy C.
Uhlovodíky s dvojnými vazbami
Uhlovodíky s jednou vazbou mezi atomy C jsou alkeny či cykloalkeny. Pokud je dvojných vazeb více, označuje se tato skutečnost předponou (např. buta-1,3-dien).
- ethen (\mathrm{{H_2C\!=\!CH_2}}) – Rostlinný hormon (podporuje např. dozrávání plodů), polymerací vzniká plast polyethylen (PE).
Významnými reakcemi uhlovodíků s dvojnou vazbou jsou adice (elektrofilní či radikálová) či polymerace.
Uhlovodíky s trojnými vazbami
Je-li v molekule jedna trojná vazba, jedná se o alkyny či cykloalkyny.
- ethyn (\mathrm{{HC\!≡\!CH}}) – Má uplatnění v chemické syntéze. Hoří za vysoké teploty, používá se ke sváření (autogen) a řezání kovů.
Typické reakce uhlovodíků s trojnými vazbami jsou adice, hydrogenace či polymerace.
NahoruAromatické uhlovodíky
Aromatické uhlovodíky (areny) obsahují aspoň jedno aromatické jádro – delokalizovaný systém π elektronů. Zjednodušeně řečeno: elektrony, které by za normálních okolností tvořily část dvojné vazby na určitém místě, jsou rovnoměrně rozprostřeny v kruhu. To zajišťuje aromatickým uhlovodíkům mimořádnou stálost.
Znázornění aromatického jádra
Vzorce níže znázorňují jednu a tu samou molekulu, elektrony tvořící π vazby nejsou vázané na konkrétní místa.
Aromatické jádro se někdy zobrazuje jako šestiúhelník s kruhem uprostřed, to je ovšem nevýhodné při uvažování o posunu elektronů v rámci chemických reakcí.
Areny obvykle mají specifický zápach. Bývají velmi těkavé (to je někdy výhodné, když se používají jako rozpouštědla), zároveň bývají nebezpečné pro zdraví.
Příklady aromatických uhlovodíků
| Název | Vzorec | Informace |
|---|---|---|
| benzen |  |
Bezbarvá kapalina, toxická, karcinogenní. Nepolární rozpouštědlo. |
| methylbenzen (triviálně toluen) |  |
Aromatické jádro s navázanou methylovou skupinou, poněkud méně toxický než benzen. Rozpouštědlo. Zneužíván jako inhalační droga. |
| ethenylbenzen (triviálně styren) |  |
Jeho polymerací vzniká plast polystyren. |
| naftalen |  |
Bílá krystalická pevná látka s typickým zápachem, dříve používán k hubení/odpuzování molů. |
Při hoření organických látek mohou vznikat polycyklické aromatické uhlovodíky (např. benzo[a]pyren sestávající z pěti aromatických jader). Tyto látky jsou značně nebezpečné pro zdraví, nacházejí se např. v cigaretovém kouři, spalinách z dopravních prostředků (jsou součástí smogu) či v grilovaných/připálených potravinách.
Reakce aromatických uhlovodíků
Typickou reakcí aromatických uhlovodíků je elektrofilní substituce (dochází k náhradě H na aromatickém jádře).
Deriváty uhlovodíků
Deriváty uhlovodíků jsou odvozené z uhlovodíků. Vznikají tak, že dojde k nahrazení atomu (či atomů) vodíku (\mathrm{H}) jinými atomy nebo funkčními skupinami. Některé jsou připravované uměle (třeba halogenderiváty), jiné jsou běžnou součástí živých organismů (zejména deriváty obsahující kyslík).
K dispozici jsou následující podtémata:
- Halogenderiváty a dusíkaté deriváty
- Halogenderiváty obsahují halogeny (nejčastěji \mathrm{Cl}, \mathrm{F}), příkladem je tetrafluorethen k výrobě teflonu.
- Dusíkaté deriváty zahrnují zejména aminy (primární obsahují skupinu \mathrm{–NH_2}, např. benzenamin = anilin). Nitrosloučeniny obsahují skupinu \mathrm{–NO_2}, např. 2,4,6-trinitrotoluen – TNT.
- Alkoholy, fenoly, ethery – Alkoholy a fenoly obsahují hydroxylovou skupinu (\mathrm{–OH}). Příkladem alkoholů je ethanol (líh). Ethery obsahují atom \mathrm{O} v uhlíkovém řetězci (\mathrm{–O–}).
- Aldehydy, ketony – Obsahují karbonylovou skupinu (\mathrm{C\!=\!O}). Příkladem aldehydů je methanal (formaldehyd), mezi ketony patří třeba propan-2-on (aceton).
- Karboxylové kyseliny – Obsahují karboxylovou skupinu (\mathrm{-COOH}). Příkladem je kyselina ethanová (octová) či citronová.
- Deriváty karboxylových kyselin – Vznikají buď nahrazeními na karboxylové skupině (funkční deriváty), nebo na uhlíkovém řetězci (substituční deriváty).
- Deriváty uhlovodíků: mix
Halogenderiváty a dusíkaté deriváty uhlovodíků
Deriváty uhlovodíků jsou odvozené z uhlovodíků. Vznikají tak, že dojde k nahrazení atomu (či atomů) vodíku (H) jinými atomy nebo funkčními skupinami.
Halogenderiváty
Halogenderiváty uhlovodíků ve svých molekulách obsahují atomy halogenů (\mathrm{F}, \mathrm{Cl}, \mathrm{Br} či \mathrm{I}). Živé organismy je vytvářejí jen velmi vzácně, většina je jich uměle vyrobena. Některé jsou netečné a víceméně zdravotně nezávadné, jiné jsou nebezpečné pro zdraví či dráždivé. Mnohé halogenderiváty patří mezi „věčné chemikálie“, v přírodě se prakticky nerozkládají a dlouhodobě ji znečišťují. Halogenderiváty na druhou stranu mnohdy mívají nezastupitelné a žádané vlastnosti.
Dále uvádíme příklady halogenderivátů:
- freony
- Různé komerčně vyráběné látky, které obsahují ve svých molekulách \mathrm{F} a \mathrm{Cl}.
- Dříve využívané freony (obsahující \mathrm{Cl}, např. R12 – difluordichlormethan) měly uplatnění v chladicích zařízeních a jako hnací látky do sprejů. Poškozovaly ovšem ozonovou vrstvu, od jejich používání se upustilo.
- V současnosti se v EU jako chladivo do klimatizací dopravních prostředků používá např. R-1234yf (2,3,3,3-tetrafluorpropen).
- tetrafluorethen
- Jeho polymerací (zřetězením molekul) vzniká polytetrafluorethen (PTFE, komerčně teflon), který se využívá např. na nepřilnavé povrchy pánví, výrobě lyžařských vosků či nepromokavých membrán do oblečení a obuvi (odpuzuje vodu). Je nehořlavý a žáruvzdorný (taje při 327 °C).
Teflon: máme se ho bát?
- Teflon sám o sobě je relativně chemicky stálý. Zdravotní riziko může plynout z jeho přehřívání (nad 260 °C), při kterém vznikají nebezpečné plyny.
- Povrch teflonových pánví se časem poškrábe, což vede k uvolňování malých částic do pokrmů.
- Při výrobě teflonu se používají další fluorované látky, které jsou toxické/nebezpečné pro zdraví. Dříve šlo o PFOA = perfluorooktanovou kyselinu, dnes jde např. látku s označením FRD-903. Teflon i doprovodné látky se v přírodě prakticky nerozkládají a předávají se v rámci potravních řetězců.
- chlorethen (vinylchlorid)
- Jeho polymerací vzniká plast PVC (polyvinylchlorid). Ten se těžko recykluje a při jeho hoření vznikají jedovaté zplodiny. Nachází nicméně využití při výrobě izolací kabelů, umělých linoleí, jednorázových rukavic či vinylových desek (gramodesek).
- tetrachlorethen (perchlorethylen)
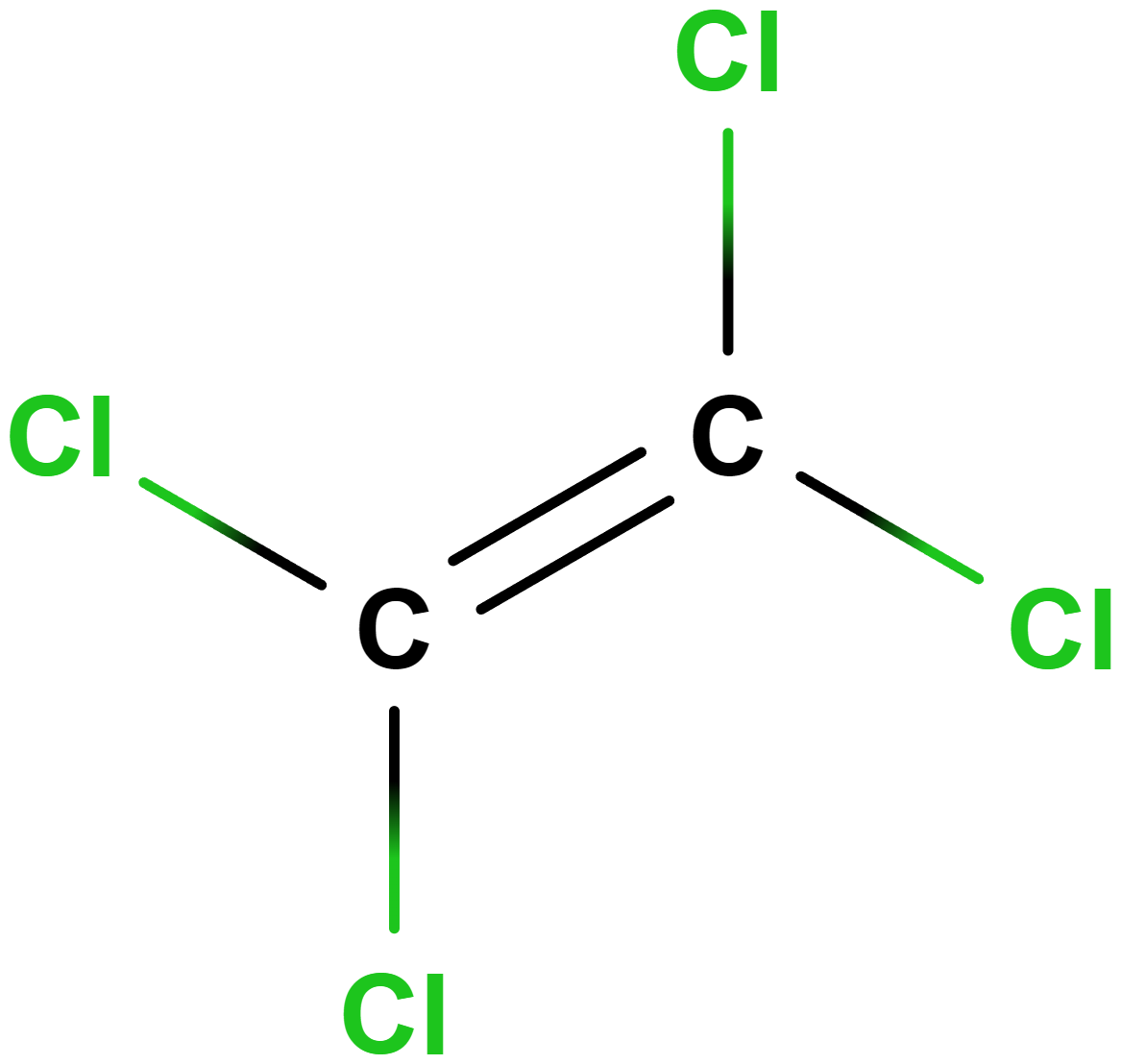
- Používá se pro suché čištění oblečení v čistírnách, dobře rozpouští tuky a další nečistoty.
- trichlormethan (chloroform)
- Dříve využíván jako anestetikum, dnes v chemické syntéze nebo jako rozpouštědlo.
Dusíkaté deriváty uhlovodíků
Mezi dusíkaté deriváty uhlovodíků patří mj. aminoderiváty a nitroderiváty.
Aminoderiváty neboli aminy obsahují v molekulách skupinu \mathrm{–NH_2}. Patří mezi ně např. anilin (vzorec níže), z něhož se syntetizují barviva či léčiva.
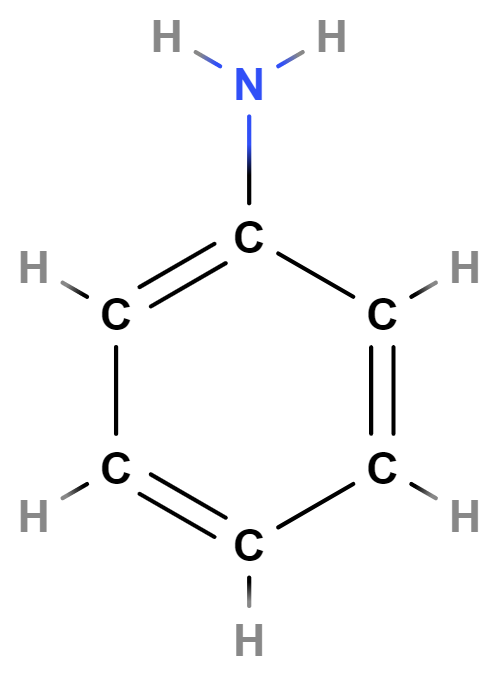
Nitroderiváty obsahují skupinu \mathrm{–NO_2}. Často se využívají k výrobě výbušnin, při jejich rozkladu vznikají obvykle \mathrm{N_2} a oxidy uhlíku v plynném skupenství. Mezi nitroderiváty patří např. TNT (trinitrotoluen) (vzorec níže) či složky trhaviny Semtex.
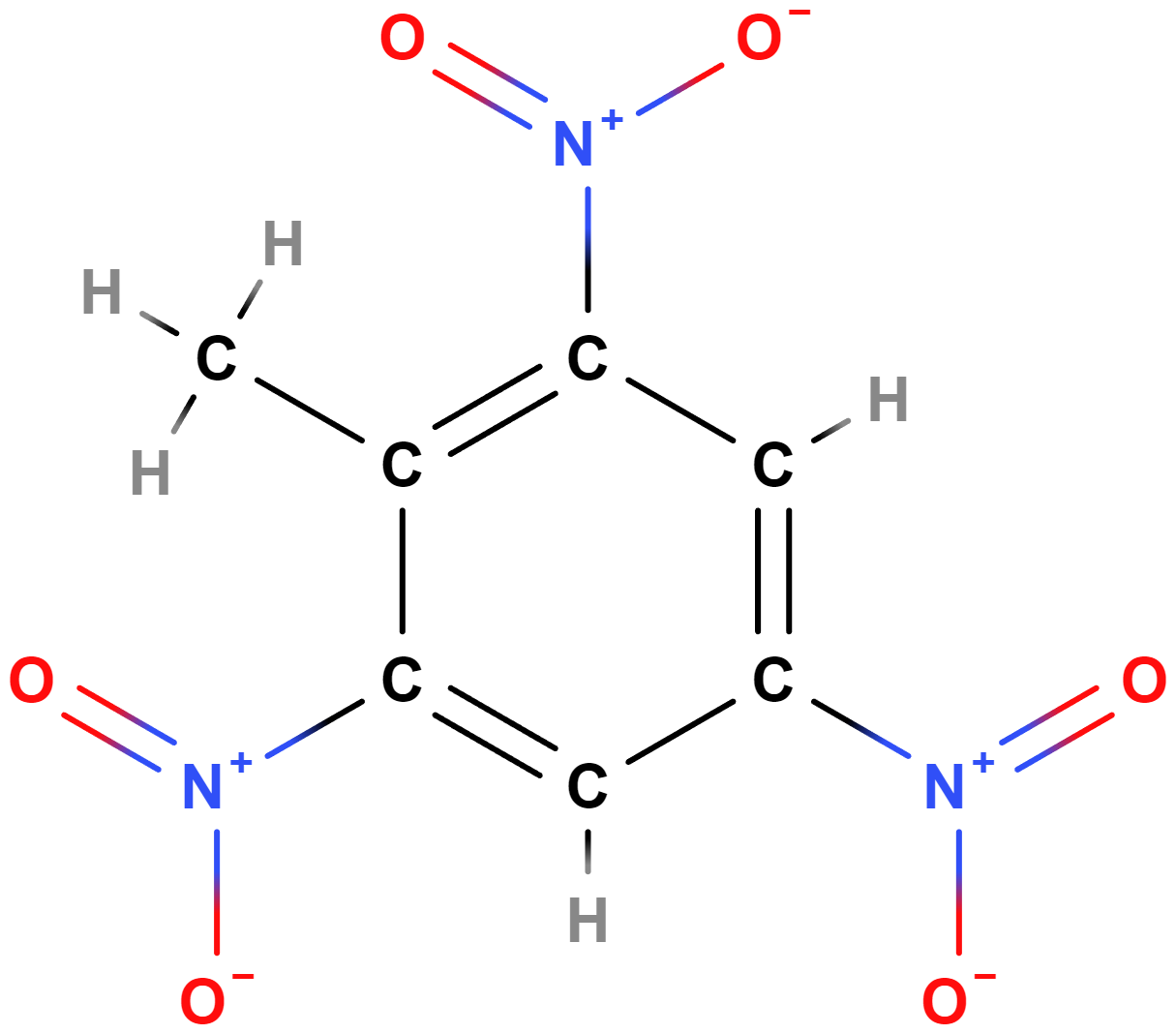
Alkoholy, fenoly, ethery
Alkoholy, fenoly i ethery patří mezi kyslíkaté deriváty uhlovodíků.
Alkoholy
Alkoholy jsou odvozené z alifatických uhlovodíků. Ve svých molekulách obsahují skupinu \mathrm{–OH}. Jejich název v základu obsahuje označení příslušného uhlovodíku s koncovkou -ol. Jde o látky běžné v přírodě, jsou dobře rozpustné ve vodě. Mezi alkoholy patří například:
- methanol
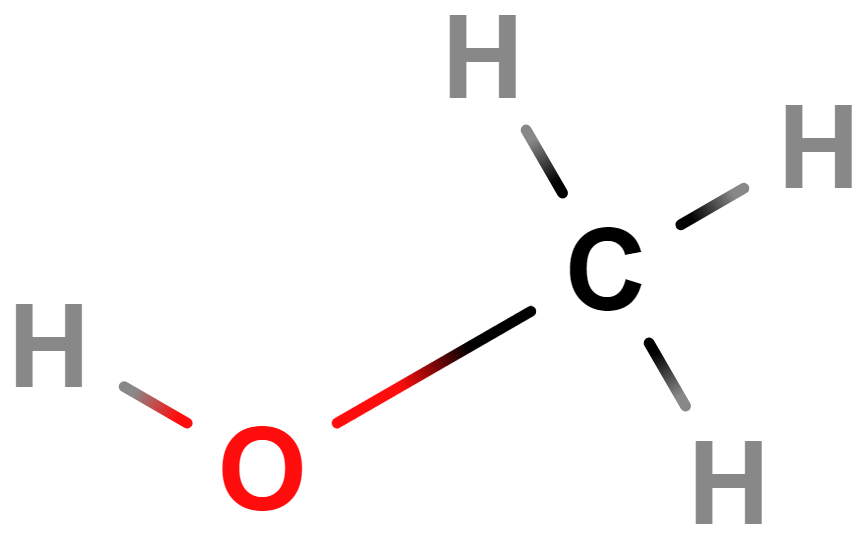
- Jedovatý, při požití hrozí oslepnutí/smrt.
- Používá se jako rozpouštědlo či k výrobě „bionafty“.
- V malém množství vzniká při kvašení, při destilaci alkoholických nápojů je nutné jej oddělit (má teplotu varu 65 °C, při zahřívání směsi se odděluje dříve než ethanol).
- V roce 2012 se v Česku odehrála methanolová aféra, kdy docházelo k ředění alkoholických nápojů methanolem. V bezprostředním časovém horizontu vedla k asi 50 úmrtím.
- ethanol (líh)
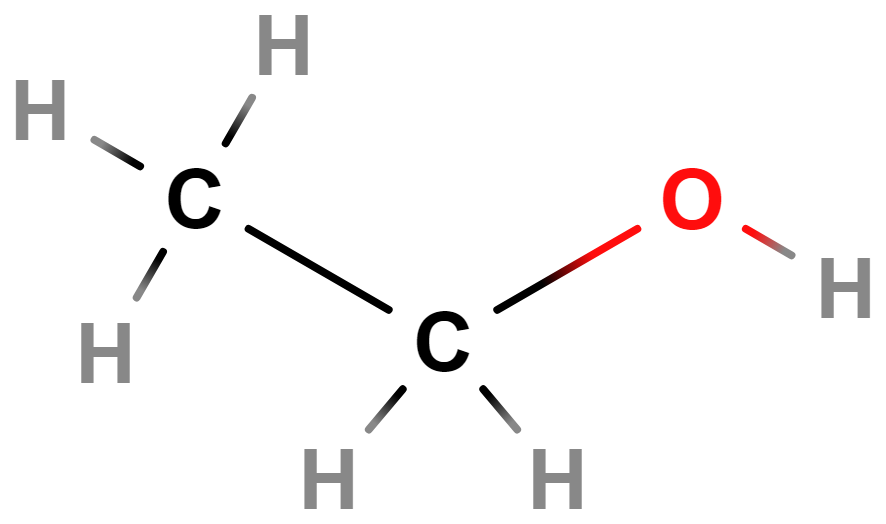
- Bezbarvá kapalina s teplotou varu 78 °C.
- Rozpouštědlo, palivo (např. do přenosných vařičů, lihových kahanů). Do lihu k technickému využití se přidávají látky, aby se nedal pít (denaturace).
- Součást alkoholických nápojů, vzniká kvašením cukrů za účasti kvasinek: \mathrm{C_6H_{12}O_6 \longrightarrow CH_3CH_2OH + CO_2}. Při požití vyřazuje z funkce určité části mozku (opilost). Pokud se mezi lidmi hovoří o „alkoholu“, myslí se tím obvykle právě ethanol.
- Játra ethanol odbourávají na toxický ethanal (acetaldehyd), který se spolu s dehydratací podílí na kocovině. Ethanal se posléze mění na kyselinu octovou, kterou lze metabolicky využít.
- Ethanol je dosud společensky tolerovanou drogou. To navzdory tomu, že jeho konzumace značně zvyšuje riziko rakoviny (nádorových onemocnění, jde o karcinogen 1. třídy) a chorob oběhového systému. Ničí játra, snadno vyvolává závislost.
- ethan-1,2-diol (ethylenglykol)
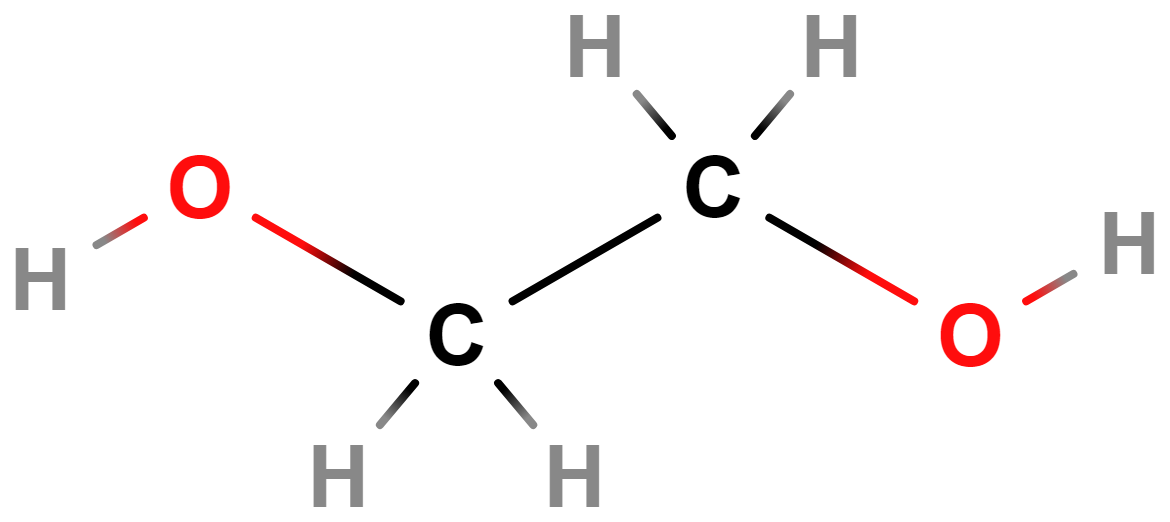
- Má teplotu tání −12,9 °C, používá se do nemrznoucích směsí či chladicích kapalin.
- propan-1,2,3-triol (glycerol)
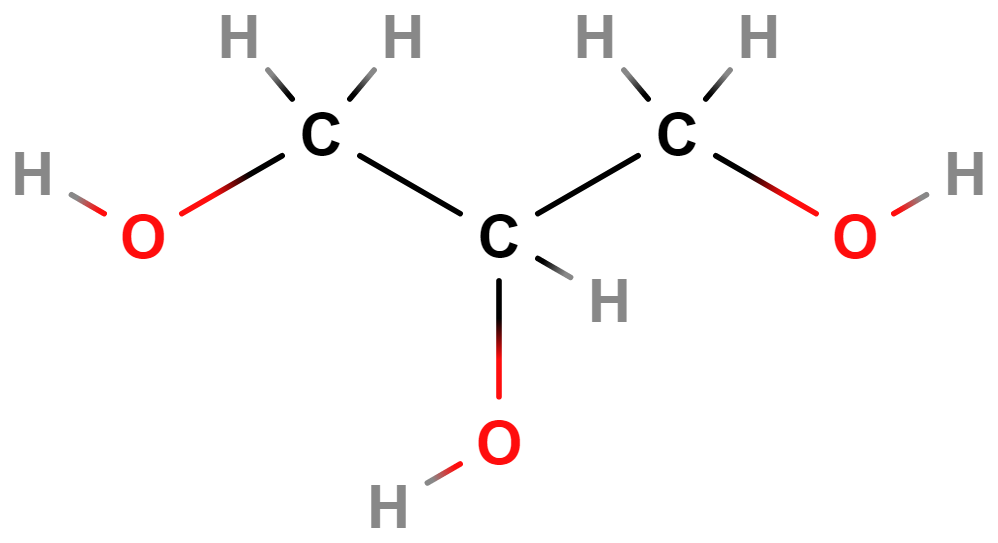
- Je součástí molekul tuků.
- Váže na sebe vodu, mnohdy se využívá v kosmetice.
Fenoly
Fenoly obdobně jako alkoholy obsahují skupinu \mathrm{–OH}, jsou však odvozené z aromatických uhlovodíků. Příkladem je fenol využívaný v chemickém průmyslu.
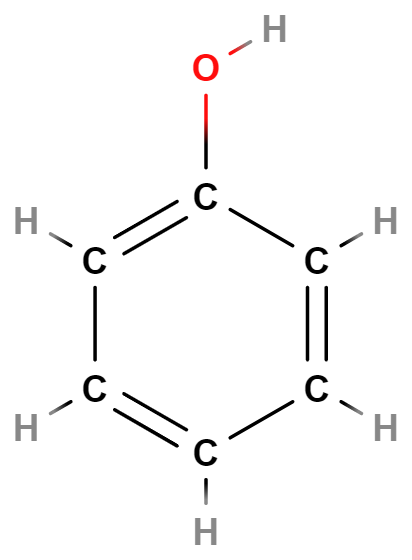
Ethery
Ve svých molekulách obsahují atom kyslíku navázaný na dva uhlovodíkové zbytky \mathrm{R–O–R'}. Příkladem je diethylether používaný jako rozpouštědlo, se vzduchem tvoří výbušné peroxidy.
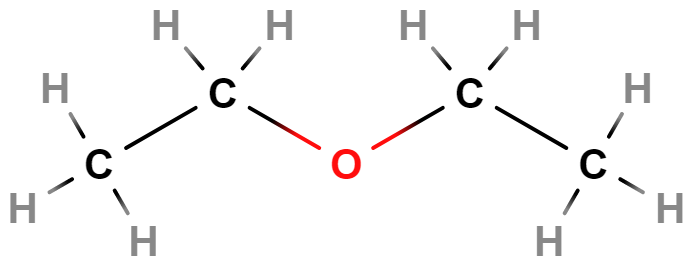
Aldehydy, ketony
Aldehydy a ketony jsou kyslíkaté deriváty uhlovodíků. Patří mezi karbonylové sloučeniny. Obsahují karbonylovou skupinu \mathrm{C\!=\!O}. Jde o látky běžné v přírodě.
Aldehydy
Aldehydy obsahují karbonylovou skupinu na konci uhlíkového řetězce. Jejich názvy mají koncovku -al. Mezi aldehydy patří například:
- methanal (formaldehyd)
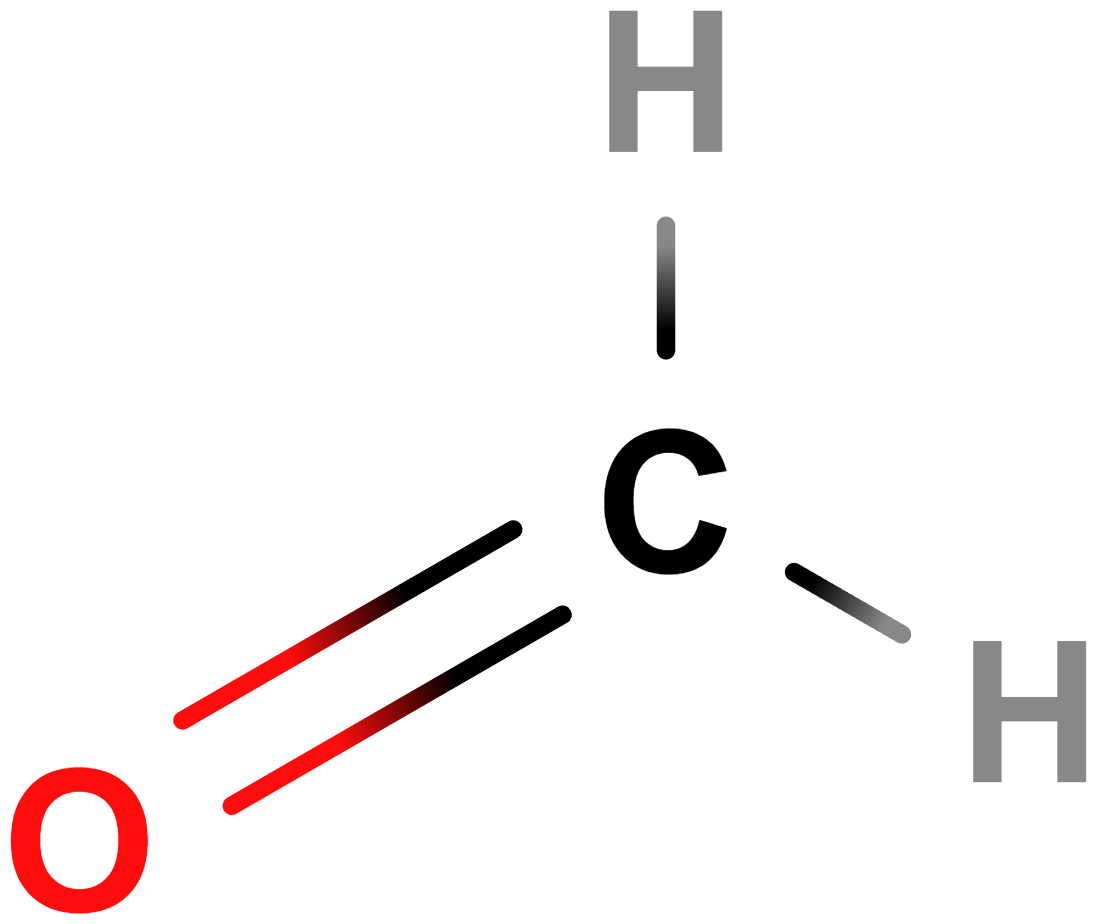
- Nejjednodušší aldehyd.
- Toxický, nebezpečný pro zdraví (karcinogenní), žíravý.
- Plyn ostrého zápachu, dobře rozpustný ve vodě. Jeho 40% roztok se označuje jako formalín, zředěný se používá ke konzervaci biologických materiálů.
- Významný pro chemický průmysl, vyrábějí se z něj různé polymery, mj. pryskyřice.
- ethanal (acetaldehyd)
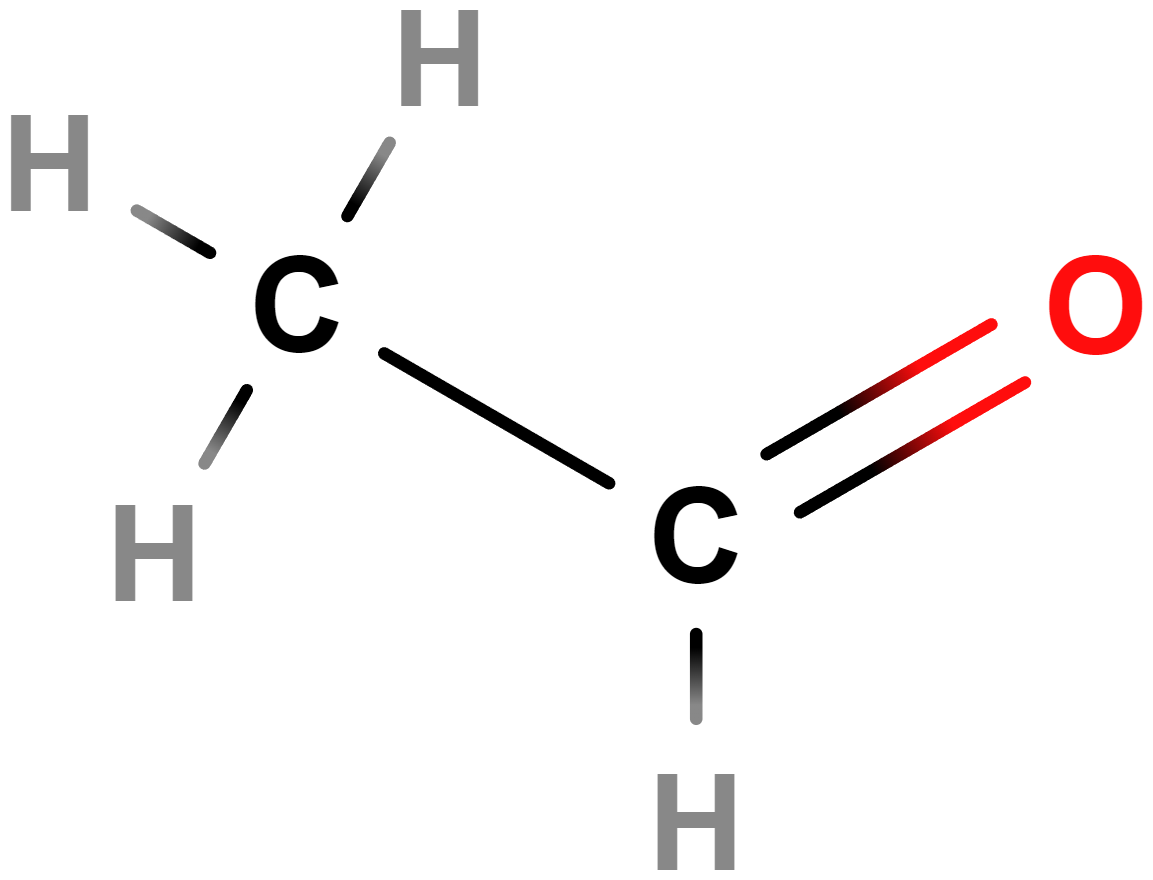
- Karcinogenní.
- Vzniká v těle při metabolických přeměnách ethanolu, podílí se na vzniku kocoviny a negativních důsledcích konzumace alkoholu.
Ketony
Ketony obsahují karbonylovou skupinu uvnitř uhlíkového řetězce. Jejich názvy mají koncovku -on.
- propan-2-on = dimethylketon (aceton)
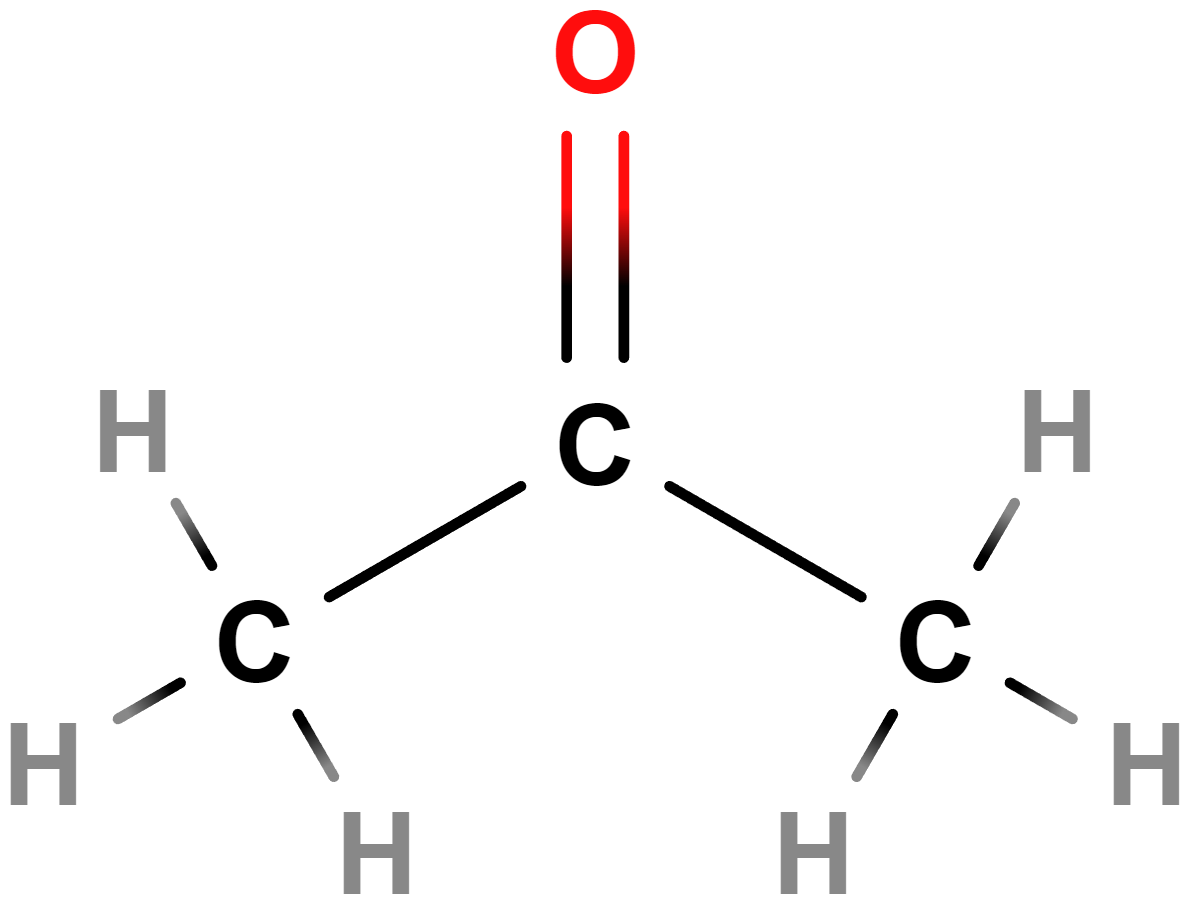
- Používá se jako rozpouštědlo.
- Hořlavý, dráždivý.
- Vzniká, když tělo přetváří tuky na cukry – jeho přítomnost v moči (či zápach v dechu) signalizuje diabetes.
Karboxylové kyseliny
Karboxylové kyseliny patří mezi kyslíkaté deriváty uhlovodíků. Jejich molekuly obsahují karboxylovou skupinu \mathrm{–COOH}. Z této funkční skupiny se snadno uvolňuje kation vodíku (\mathrm{H^+}), což podmiňuje kyselý charakter těchto látek. Karboxylové kyseliny se běžně nacházejí v živých organismech. Karboxylové kyseliny s krátkým uhlíkovým řetězcem mají obvykle štiplavý zápach.
Příklady karboxylových kyselin
- kyselina methanová (mravenčí)
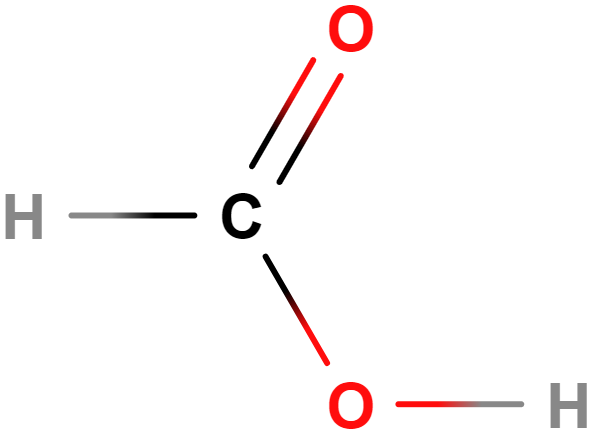
- Využívána mravenci k obraně, v žahavých chlupech kopřiv je jen v malém množství.
- Má uplatnění při hubení kleštíka včelího ve včelstvech, konzervuje rostlinnou hmotu při silážování.
- kyselina ethanová (octová)
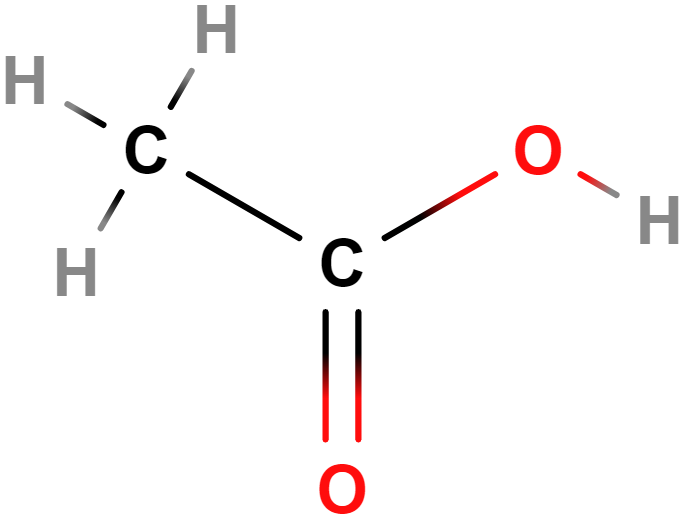
- Ocet je zpravidla 5–8% roztok. Pro potravinářské účely se vyrábí octovým kvašením ethanolu (ocet kvasný lihový, obvykle bývá uměle obarven), případně ovocných šťáv (např. jablečný ocet) či vína (balzamikový, vinný ocet).
- kyselina butanová (máselná)
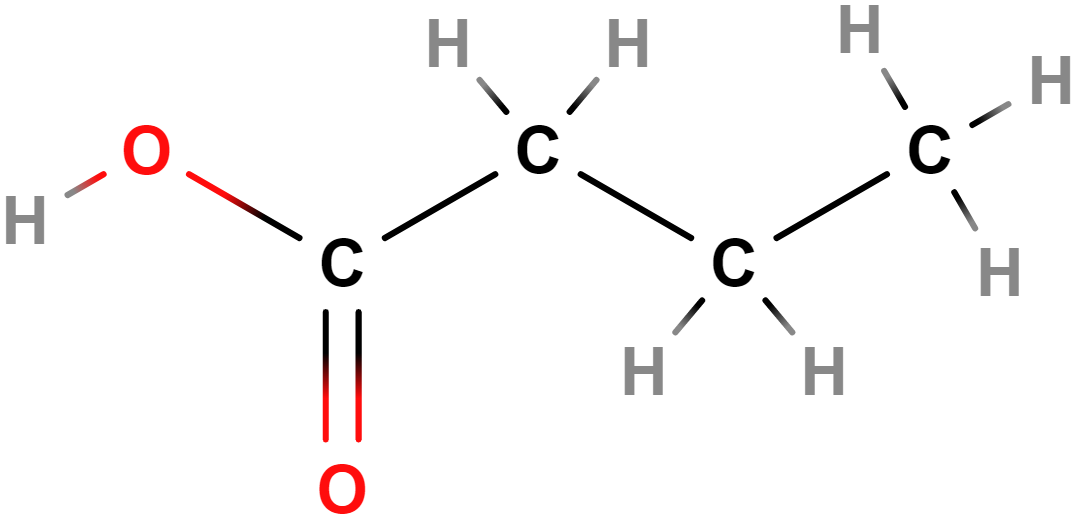
- Uvolňuje se při rozkladu tuků (např. metabolizaci tuků bakteriemi). Způsobuje např. aroma sýrů (parmezán, olomoucké tvarůžky, romadur aj.), ale také zvratků či potu.
- kyselina benzoová
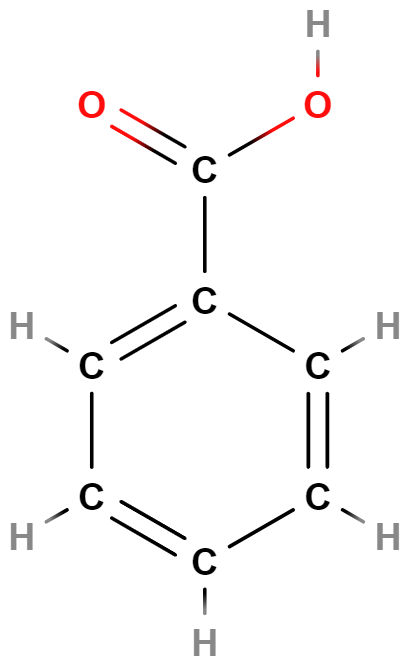
- Používá se jako konzervant.
- kyselina citronová
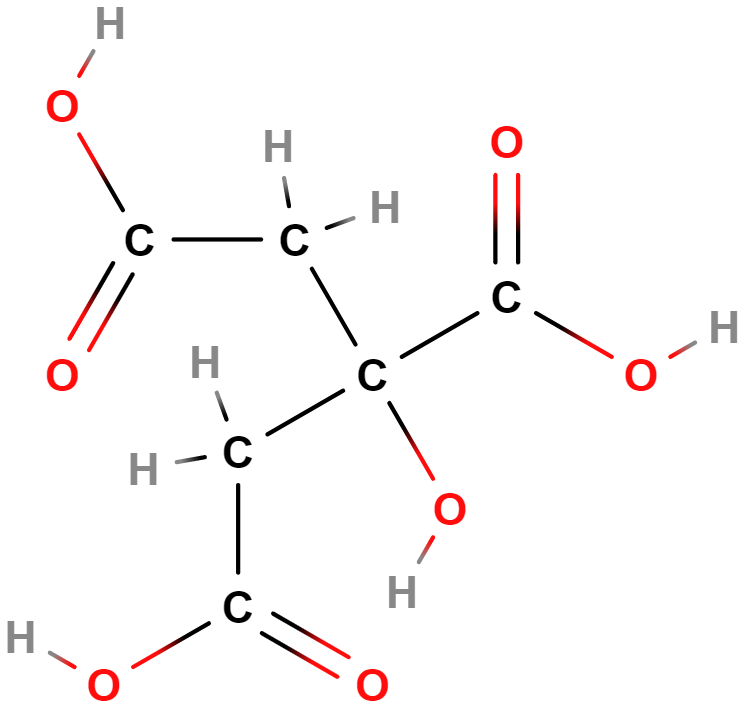
- Používá se jako konzervant či k okyselení potravin/nápojů.
- Je meziproduktem metabolismu v rámci buněčného dýchání (Krebsův cyklus = citrátový cyklus).
Mastné kyseliny tvoří součásti molekul tuků. Vyšší mastné kyseliny (např. kyselina palmitová, stearová, olejová) mají delší uhlíkové řetězce.
NahoruDeriváty karboxylových kyselin
Mezi funkční deriváty karboxylových kyselin patří např. jejich soli a estery. Funkční deriváty karboxylových kyselin vznikají vlivem zásahů do karboxylové skupiny.
Soli karboxylových kyselin
Soli karboxylových kyselin vznikají zejména jejich neutralizací. Dojde k odštěpení vodíkového kationtu (\mathrm{H^+}) z molekuly kyseliny a jeho nahrazení, nejčastěji iontem kovu. Mezi soli karboxylových kyselin patří například:
- octan sodný – Používá se proti otokům a naraženinám.
- benzoan sodný – Používá se jako konzervant.
- glutaman sodný – Jedná se o sůl aminokyseliny (kyseliny glutamové), způsobuje chuť umami.
- šťavelan vápenatý – Nerozpustná sůl, mnohdy přítomná v rostlinách (např. árónovitých). Tvoří drobné krystalky, které slouží rostlinám jako obrana před býložravci. Tato sůl je obsažena i v ledvinových kamenech.
Mýdla obsahují sodné nebo draselné soli vyšších mastných kyselin. Jejich molekuly jsou zčásti hydrofobní (odpuzují vodu, vážou se na ně nečistoty), zčásti hydrofilní (přitahují vodu, která je může i s navázanými nečistotami odplavit).
Estery karboxylových kyselin
Estery karboxylových kyselin jsou v přírodě významnými vonnými látkami (jsou např. součástí plodů, květů). Vznikají reakcí karboxylové kyseliny a alkoholu (esterifikací), produktem reakce je ester a voda. Používají se např. jako aromata do potravin, rozpouštědla či k výrobě plastů.
Ethylester kyseliny octové (ethyl-ethanoát) má využití v odlakovačích na nehty a jako rozpouštědlo. Methylestery mastných kyselin (MEŘO = methylester řepkového oleje) jsou součástí biosložky nafty. Tuky jsou přirozeně se vyskytující estery mastných kyselin a propan-1,2,3-triolu (glycerolu).
Substituční deriváty karboxylových kyselin
Substituční deriváty karboxylových kyselin mají navázané další funkční skupiny na uhlíkovém řetězci. Patří mezi ně např. hydroxyderiváty karboxylových kyselin (atomy \mathrm{H} jsou nahrazeny skupinou \mathrm{–OH}), halogenkarboxylové kyseliny (atomy \mathrm{H} jsou nahrazeny atomy halogenů) či aminokyseliny (atomy \mathrm{H} jsou nahrazeny skupinou \mathrm{–NH_2}).
Biochemie
Biochemie se zabývá látkami v živých organismech (většinou jde o organické látky) a jejich přeměnami.
Jednotlivé skupiny přírodních látek popisují následující kapitoly:
- Lipidy – Tuky, vosky a další látky nerozpustné ve vodě.
- Sacharidy – Cukry a příbuzné látky. Bývají pohotovým zdrojem energie či se podílejí na stavbě organismů.
- Proteiny – Bílkoviny, skládají se z aminokyselin. Zajišťují stavbu i funkci živých organismů.
- Enzymy – Umožňují průběh chemických reakcí v živých organismech.
- Nukleové kyseliny – Nesou informace o tom, jak organismy budou vypadat a fungovat.
- Vitaminy – Organismy je potřebují v malém množství.
- Alkaloidy a návykové látky – Látky, které využívají zejména rostliny k obraně. Některé z nich mohou způsobovat závislost.
- Skupiny přírodních látek: mix
Metabolickými přeměnami látek se zabývají tyto kapitoly:
- Fotosyntéza – Ukládání energie světla do chemických vazeb.
- Buněčné dýchání, kvašení – Uvolňování energie oxidací organických sloučenin.
- Reakce v živých organismech: mix
Lipidy jsou skupinou látek nepolární povahy, jsou obvykle nerozpustné ve vodě. Patří mezi ně tuky, steroly, fosfolipidy nebo vosky.
Tuky (a související)
Molekuly tuků v základu sestávají z části pocházející z propan-1,2,3-triolu (glycerolu) a zpravidla ze 3 zbytků mastných kyselin (proto se také označují jako triacylglyceroly, chemicky jde o estery mastných kyselin). Mastné kyseliny jsou zpravidla vyšší karboxylové kyseliny. Mohou být:
- nasycené – Obsahují v uhlíkovém řetězci jen jednoduché vazby. Tuky s převahou těchto mastných kyselin jsou při pokojové teplotě zpravidla tuhé. Patří sem např. kyselina stearová či palmitová.
- nenasycené – Obsahují v uhlíkovém řetězci dvojné vazby. Tuky s převahou těchto mastných kyselin jsou při pokojové teplotě zpravidla tekuté (oleje). Patří sem např. kyselina olejová.
Funkce tuků v živých organismech
Tuky se v živých organismech podílejí na tepelné izolaci, jsou to významné zásobní látky (mezi běžnými živinami na jednotku hmotnosti obsahují nejvíc energie), mohou chránit orgány (např. ledviny) či určité části těla (např. myelinová pochva na výběžcích neuronů sestává zčásti z tuku). V tucích jsou rozpustné některé vitaminy. Fosfolipidy (látky příbuzné tukům, obsahují v molekule zbytek kyseliny fosforečné) jsou zásadní součástí membrán buněk.
Cholesterol
Cholesterol je látka steroidní povahy. Společně s proteiny a tuky tvoří váčky, které přesouvají tuky po těle. Zvýšená hladina těchto částic (zejména LDL = low density lipoprotein) vede k usazování tuků na stěnách cév, což zvyšuje např. riziko cévní mozkové příhody či srdečního infarktu. Cholesterol je také přirozenou součástí buněčných membrán. Je to výchozí látka pro tvorbu steroidních hormonů (v lidském těle např. testosteron, estrogeny, progesteron, kortizol).
Žluknutí je rozklad molekul tuků, často vlivem činnosti bakterií.
Tuky lze získávat ze živočichů (např. sádlo či lůj z podkožního tuku, máslo z mléka, rybí tuk) i rostlin (zejména z plodů a semen, např. palma olejná, slunečnice, řepka, olivovník, kokosovník).
Ztužování tuků
Ztužování tuků je přeměna kapalného oleje na pevný tuk. Provádí se díky hydrogenaci (reakci s vodíkem, dojde k přeměně dvojných vazeb v mastných kyselinách na jednoduché), pro získání tuku specifické konzistence lze dále provádět transesterifikaci (výměnu mastných kyselin mezi molekulami tuků). Díky ztužení vznikají např. margaríny či různé tuky na pečení.
Vosky
Vosky jsou estery mastných kyselin a jednosytných alkoholů s vyšším počtem atomů uhlíku. Příkladem je včelí vosk či vosky tvořící kutikulu rostlin (výrazná je zvláště u sukulentů, které díky ní zamezují ztrátám vody). Vosky jsou významnou součástí lanolinu, který se získává z ovce domácí a používá se v kosmetice či kožních léčivech.
NahoruSacharidy
Sacharidy jsou skupinou přírodních látek. Většinou mají rostlinný původ, vznikají v rámci fotosyntézy. Sacharidy sestávají z jedné či více monosacharidových jednotek. Obsahují atomy \mathrm{C}, \mathrm{O}, \mathrm{H}.
Monosacharidy
Nejjednodušší sacharidy, jejich molekuly jsou samy o sobě monosacharidovou jednotkou. Patří sem například:
- glukosa (hroznový, krevní cukr) – V plodech rostlin. Rychlý zdroj energie pro buňky lidského těla, jeho hladina v krvi se označuje jako glykemie (glukosemie). Vzniká mnohdy rozkladem složitějších sacharidů.
- fruktosa – V plodech rostlin, společně s glukosou v medu. Sladší než glukosa.
- galaktosa – V mléce savců, součástí molekul laktosy.
Sacharidy v nukleových kyselinách
Mezi monosacharidy patří i ribosa, která je součástí RNA, a 2-deoxyribosa, která tvoří kostru molekul DNA.
Disacharidy
Jejich molekuly jsou ze dvou monosacharidových jednotek.
- sacharosa – V mírném pásu se získává z cukrové řepy, zdrojem sacharosy v (sub)tropech je cukrová třtina. Tento cukr je běžně využíván v kuchyni (krystal, krupice, moučka). Hnědý řepný či třtinový cukr je buď nerafinovaný (obsahuje zbytky melasy), nebo druhotně obarvený karamelem. Hnědý i bílý cukr jsou prakticky jen sacharóza, jejich vliv na organismus je tedy totožný. Molekula sestává z jednotky glukosy a jednotky fruktosy.
- laktosa – V mléce savců. Někteří lidé mají intoleranci laktosy (v dospělosti u nich nefunguje enzym laktáza, který laktosu štěpí; vede k zažívacím obtížím). Molekula sestává z jednotky glukosy a galaktosy.
- maltosa – Sladový cukr, vzniká např. při klíčení obilek ječmene. Molekula sestává ze dvou jednotek glukosy.
Jednoduché sacharidy (monosacharidy a disacharidy) obvykle chutnají sladce a označují se jako cukry.
Polysacharidy
Jejich molekuly jsou z většího množství (>10) monosacharidových jednotek.
- škrob – Hlavní zásobní látka rostlin (např. v bramborách, rýži, obilovinách). V těle štěpen enzymem α-amylázou. Tvořen velkým množstvím jednotek glukosy, ty jsou uspořádány do molekuly amylosy a amylopektinu.
- celulosa – Pro člověka nestravitelná, součást vlákniny. U rostlin jde o stavební sacharid, tvoří buněčné stěny. Celulosu obsahuje např. papír, vata, bavlna.
- glykogen – Zásobní látka živočichů, zejména v játrech a svalech. Je tvořen rozvětvenými řetězci glukosy.
Chemická podstata sacharidů
Sacharidy jsou z chemické hlediska hydroxyaldehydy (aldosy, nejjednodušší je glyceraldehyd) či hydroxyketony (ketosy, nejjednodušší je dihydroxyaceton).
Vzorce sacharidů, cyklické formy
Co se týče znázornění molekul sacharidů, používají se:
- Fischerovy vzorce (a) – Zobrazují lineární strukturu sacharidů.
- Tollensovy vzorce (b) – Naznačují vznik cyklické formy.
- Haworthovy vzorce (c) – Zobrazují cyklické formy, lze jimi znázornit konfiguraci na stereocentru, které vzniklo vytvořením cyklu (vyznačeno žlutě; možné konfigurace α, β). Cyklické formy bývají nejčastěji furanosy (5členný cyklus) či pyranosy (6členný cyklus). Některé sacharidy se preferovaně vyskytují v cyklických formách.
Proteiny (jiným označením bílkoviny) jsou složité organické látky, které se podílejí na stavbě a fungování všech živých organismů.
Chemická podstata proteinů
Proteiny se v základu skládají z 20 druhů aminokyselin. Aminokyseliny jsou odvozené z karboxylových kyselin, na uhlíkovém řetězci mají navázanou aminoskupinu \mathrm{–NH_2}. Proteiny sestávají z nevětveného řetězce aminokyselin, který může být různě prostorově uspořádaný. Prostorové uspořádání proteinu bývá úzce spojeno s jeho funkcí v organismu. Proteiny obsahují více než 100 aminokyselinových jednotek spojených peptidickou vazbou.
Peptidy
Látky sestávající z méně než 100 aminokyselin se označují jako peptidy. Např. hormon inzulin je peptid.
Struktura proteinů
- primární – Pořadí aminokyselin v řetězci.
- sekundární – Uspořádání aminokyselinového řetězce v prostoru, v základu α-helix (šroubovice) či β-sheet (skládaný list).
- terciární – Celkové uspořádání molekuly v prostoru, např. fibrilární (tvoří vlákna, např. kolagen) či globulární (tvoří „klubka“ – např. součásti hemoglobinu).
- kvartérní – Vzájemné uspořádání více polypeptidových řetězců.
Struktura proteinu je určena složitými interakcemi mezi aminokyselinami, např. přítomností vodíkových či disulfidických můstků.
Denaturace je proces, kdy proteiny ztrácejí své prostorové uspořádání (např. vlivem teploty, přítomnosti těžkých kovů, změny pH) a tím pádem i funkčnost. Denaturace v kuchyni běžně probíhá např. při tepelné úpravě masa či vajec.
Tvorba a zdroje proteinů
Rostliny jsou schopné aminokyseliny vytvářet z anorganických sloučenin dusíku, živočichové musejí některé aminokyseliny přijímat v potravě (ty se označují jako esenciální).
Živé organismy si tvoří vlastní proteiny z aminokyselin na základě informace zahrnuté v nukleových kyselinách (zejména DNA). Pokud tedy např. přijmeme protein v potravě, v trávicí soustavě se rozloží na aminokyseliny, z nichž se následně v buňkách vytvoří naše „vlastní“ proteiny.
Typickými zdroji bílkovin (respektive aminokyselin) jsou např. vejce, mléko, maso, obiloviny či luštěniny.
Příklady funkcí proteinů v živých organismech
- stavba – Různé proteiny tvoří cytoskelet (buněčnou kostru). Keratin je ve velkém množství přítomný v kůži. Kolagen je obsažen třeba v chrupavkách či kostech.
- transport – Např. hemoglobin přenáší po těle obratlovců kyslík.
- pohyb – Stahování svalů umožňují zejména proteiny aktin a myozin. Právě tyto proteiny jsou zdrojem aminokyselin při konzumaci masa.
- ochrana – Imunoglobuliny (protilátky) zajišťují funkci imunitního systému, váží se na patogeny či narušené buňky.
- řízení organismu – Mnohé hormony (např. oxytocin, antidiuretický hormon, inzulin) jsou bílkovinného charakteru.
- umožňování průběhu chemických reakcí – Enzymy z převážné části sestávají z proteinů.
Jako zdroj energie proteiny slouží obvykle jen při vyčerpání jiných živin.
Enzymy (biokatalyzátory) jsou nezbytné pro fungování všech živých organismů. Urychlují chemické reakce, které probíhají v jejich buňkách i mimo ně. Umožňují průběh reakcí, které by jinak za daných podmínek prakticky neprobíhaly, snižují jejich aktivační energii. Enzymy se mohou se podílet např. na trávení, tvorbě a kopírování nukleových kyselin, proteosyntéze, uvolňování energie či fungování svalů.
Enzymy se připravují i uměle (často za pomoci geneticky upravených bakterií), využívají se např. do čisticích prostředků, při výrobě potravin či v lékařství.
Chemická podstata enzymů
Enzymy jsou převážně proteiny. Mohou navíc obsahovat nebílkovinné části, kofaktory. Mezi kofaktory patří např. organické molekuly, vitaminy či ionty kovů.
Typy kofaktorů
Kofaktory se rozdělují do následujících skupin.
- Koenzymy jsou slabě vázané na proteinovou část enzymu. Přenášejí vodík, elektrony či skupiny atomů mezi molekulami. Vyskytují se ve dvou podobách (např. \mathrm{NADPH}/\mathrm{NADP^+}).
- Prostetické skupiny mají s bílkovinnou složkou pevnou (někdy i kovalentní) vazbu.
- Ionty kovů mohou mít k bílkovinné části enzymu různý vztah.
Účinek a aktivita enzymů
Enzymy obvykle mají specifický účinek, urychlují často jednu reakci (či jednotky reakcí). Obsahují aktivní místo, které svým tvarem umožňuje přijetí substrátu (výchozí látka, na kterou enzym působí). Enzym se substrátem vytvoří enzym-substrátový komplex, následně dochází k přeměně a uvolnění produktu.
Aktivita enzymů je ovlivňována koncentrací substrátu, enzymu, pH či teplotou. Inhibitory jsou látky, které zpomalují či zastavují aktivitu enzymů.
Typy inhibice
- reverzibilní (vratná)
- kompetitivní – Inhibitory „souteží“ se substrátem o pozici v aktivním místě.
- akompetitivní – Inhibitor se váže na enzym-substrátový komplex a zabraňuje přeměně.
- nekompetitivní – Inhibitory se váží na tzv. alosterická místa a zpomalují reakci.
- ireverzibilní – Dochází k nevratnému poškození enzymu chemickou změnou či navázáním enzymového jedu.
Třídění enzymů
Enzymy se podle charakteru prováděných reakcí dělí do 7 skupin.
Klasifikace enzymů
- oxidoreduktázy – Urychlují redoxní reakce.
- transferázy – Přenášejí funkční skupiny.
- hydrolázy – Umožňují štěpení vazeb ve vodném prostředí.
- lyázy – Štěpí chemické vazby jinak než ve vodném prostředí či pomocí redoxních reakcí.
- izomerázy – Umožňují vznik izomerů, přenášejí atomy v rámci molekul.
- ligázy – Spojují molekuly.
- translokázy – Přenášejí částice přes biomembrány.
Ribozymy
Katalyzovat chemické reakce může také RNA, v takovém případě se hovoří o ribozymech.
Nukleové kyseliny
Nukleové kyseliny nesou genetickou (dědičnou) informaci živých organismů. Jedná se o biopolymery skládající se z nukleotidů. Každý nukleotid obsahuje dusíkatou bázi, zbytek kyseliny fosforečné a sacharidovou část.
Mezi základní nukleové kyseliny patří DNA a RNA:
- DNA (deoxyribonukleová kyselina) má zpravidla podobu pravotočivé dvoušroubovice. Sestává z nukleotidů obsahujících adenin (A), thymin (T), guanin (G), cytosin (C). Každý nukleotid obsahuje zbytek deoxy-D-ribosy. U bakterií se DNA nachází volně v cytosolu, u eukaryotních organismů (zejména živočichů, rostlin, hub) se mimo dobu dělení buňky nachází v buněčném jádře. Také je přítomna v semiautonomních organelách. Samostatné molekuly DNA se označují jako chromozomy.
- RNA (ribonukleová kyselina) je zpravidla jednovláknová, sestává z nukleotidů obsahujících adenin (A), uracil (U), guanin (G), cytosin (C). Obsahuje zbytek D-ribosy. Má zpravidla kratší životnost než DNA.
Dědičnou informaci předávají rodiče potomkům při rozmnožování. Informace obsažené v DNA, respektive RNA, mohou být podkladem pro tvorbu proteinů (bílkovin), které zodpovídají za vytváření znaků organismů. RNA také může fungovat jako katalyzátor (tvoří ribozymy).
Nukleové kyseliny/chromozomy mohou podléhat změnám v rámci mutací. Ty mohou být navozené i cíleně, např. při vytváření geneticky modifikovaných organismů (GMO).
Tipy k procvičování
Tato kapitola nabízí jen stručný „průlet“ tématem nukleových kyselin. Podrobnější vhled do tématu lze získat v kapitole věnované genetice na předmětu biologie.
Vitaminy jsou organické látky, které živé organismy k zachování životních funkcí či růstu potřebují v malém množství (jde o mikronutrienty). Živočichové či houby je přijímají s potravou nebo si je sami tvoří (např. z provitaminů, které mohou být na vitaminy v organismu přeměněny). Rostliny si veškeré vitaminy vytvářejí samy.
Vitaminy mohou umožňovat funkci enzymů (jako kofaktory) nebo působit jako antioxidanty.
Vitaminy a imunita
Vitaminy bývají často zavádějícím způsobem spojovány pouze s podporou imunity. Imunitu nepodporují přímo. Zajišťují průběh mnoha procesů v organismu, včetně dílčích procesů spojených s imunitou.
Vitaminy rozpustné ve vodě
Ve vodě je rozpustný vitamin C a vitaminy skupiny B.
- vitamin C (kyselina askorbová) – Funguje jako antioxidant. Je nezbytný pro syntézu proteinu kolagenu (ten je např. nezbytnou součástí kůže, tvoří se při hojení ran). Zdrojem je zejména ovoce a zelenina.
- vitaminy skupiny B – Podílejí se na metabolických přeměnách či krvetvorbě. Mezi významné zdroje patří vejce, mléko, maso, kvasnice. Vitamin B₁₂ je přítomen ve větší míře jen v živočišných produktech, u vegetariánů či veganů je vhodné myslet na jeho odpovídající příjem. Vitaminy skupiny B jsou tvořeny i střevním mikrobiomem.
Vitaminy rozpustné v tucích
V tucích jsou rozpustné vitaminy A, D, E, K.
- vitamin A – Nezbytný pro tvorbu pigmentů v sítnici. Antioxidant. Nachází se např. v játrech. Při nadměrném příjmu vitaminu A v těhotenství hrozí poškození zárodku/plodu. Jeho provitaminem je β-karoten (např. v mrkvi).
- vitamin D – Má vliv na metabolismus vápníku, vývoj kostí a zubů. Výchozí látka nutná k jeho tvorbě se v těle tvoří působením UV záření na cholesterol.
- vitamin E – Antioxidant. Např. v ořeších, semenech, zelenině.
- vitamin K – Podílí se na srážení krve. Např. v rostlinných olejích, zelenině. Tvoří ho bakterie v tlustém střevě.
Hypervitaminóza je nadměrný příjem vitaminu, hypovitaminóza naopak jeho nedostatek. V rozvinutých zemích je nedostatek vitaminů vzácný, jejich dostatečné množství je obsaženo ve vyvážené stravě.
NahoruFotosyntéza
Fotosyntéza je děj, při kterém se energie světla ukládá do energie chemických vazeb. Mezi fotosyntetizující organismy patří mj. rostliny, řasy či sinice (fotosyntetizující bakterie).
Fotosyntéza je zásadní pro život na Zemi. Fotosyntetizující organismy jsou základem potravních řetězců. Organické látky vzniklé fotosyntézou se v potravních řetězcích předávají jakožto nositelé energie. Když například sníme jablko, získáme živiny, které vytvořila fotosyntézou jabloň a uložila je do svého plodu.
Průběh fotosyntézy
V rámci fotosyntézy se spotřebovává oxid uhličitý a voda (jednoduché anorganické látky), využívá se energie světla. Vznikají organické látky bohaté na energii (živiny, jde o sloučeniny uhlíku) a kyslík.
Spotřebováváním oxidu uhličitého fotosyntetizující organismy regulují jeho množství v atmosféře.
Mezi organické látky bohaté na energii vznikající fotosyntézou patří v základu sacharidy (cukry). Fotosyntéza přispívá i ke vzniku tuků a aminokyselin, z nichž se vytvářejí bílkoviny (proteiny). Organismy využívají látky vzniklé fotosyntézou jako zdroj energie nebo jako stavební látky.
Kyslík vznikající fotosyntézou je nedílnou součástí atmosféry a u živých organismů (včetně těch fotosyntetizujících) je potřeba k buněčnému dýchání.
Chemická rovnice fotosyntézy
Chemicky lze fotosyntézu popsat takto: \mathrm{6\, CO_2 + 6\,H_2O \longrightarrow C_6H_{12}O_6 + 6\,O_2}
Bezprostředně využitelná energie
V rámci dějů spojených fotosyntézou kromě živin a kyslíku vzniká do určité míry i bezprostředně využitelná energie ve formě sloučeniny ATP.
Fotosyntéza a buňky
Fotosyntéza probíhá v buňkách organismů. U organismů se složitější (eukaryotní) buňkou, např. rostlin, probíhá v tzv. chloroplastech.
Fotosyntetická barviva
Zachycování světla při fotosyntéze v základu zajišťuje zelené barvivo chlorofyl. Pro fotosyntézu se využívá zejména modrá a červená složka viditelného světla. Zelené světlo chlorofyl odráží, proto fotosyntetizující součásti rostlin vnímáme jako zelené.
Fotosyntézou se zachytí asi 1–2 % energie slunečního záření dopadajícího na Zemi. Fotosyntéza může probíhat i za umělého osvětlení.
Podmínky fotosyntézy
U rostlin mírného pásu je optimální teplota pro fotosyntézu asi 15–25 °C. Na průběh fotosyntézy má dále vliv dostupnost vody, oxidu uhličitého a světla.
Fáze fotosyntézy
Fotosyntéza probíhá ve dvou souvisejících fázích.
- V rámci tzv. primární (světelné) fáze probíhá rozklad vody světlem – fotolýza vody. Vzniklé částice se podílejí na vzniku redukovaných koenzymů, které jsou potřeba pro sekundární fázi.
- Sekundární (temnostní) fáze zahrnuje fixaci oxidu uhličitého (\mathrm{CO_2}) do organických látek za účasti redukovaných koenzymů (v základu tzv. Calvinův cyklus).
Primární i sekundární fáze fotosyntézy probíhají současně. V rámci sekundární fáze sice není potřeba světlo samo o sobě, ale redukované koenzymy vznikající v primární fázi se spotřebují obvykle poměrně rychle (v řádu minut).
Typy fotosyntézy v souvislosti se sekundární fází
- U tzv. \mathrm{C_3} rostlin je produktem sekundární fáze (Calvinova cyklu) 3uhlíkatá sloučenina 3-fosfoglycerát. Tento typ fotosyntézy využívá většina rostlin mírného pásu.
- \mathrm{C_4} rostliny fixují \mathrm{CO_2} v buňkách mezofylu (vnitřní tkáň listu) do 4uhlíkatého oxalacetátu (Hatchův–Slackův cyklus). Další zpracování oxalacetátu (Calvinův cyklus) probíhá v buňkách cévních svazků. \mathrm{C_4} fotosyntéza je typická pro tropické rostliny a sukulenty.
- Rostliny s CAM fotosyntézou během dne fixují \mathrm{CO_2} za vzniku malátu, přes den malát dále zpracovávají Calvinovým cyklem.
Prostorovým (u C4 rostlin) či časovým (u CAM rostlin) oddělením dějů se předchází tzv. fotorespiraci (navazování kyslíku na enzym Rubisco, které omezuje účinnost fotosyntézy).
Bezpečnost v chemii
Při práci s chemickými látkami a směsmi je nutné dbát na bezpečnost. Musíme být informovaní o tom, se kterými chemikáliemi pracujeme, jaké mají vlastnosti, co při práci s nimi dodržovat (např. které ochranné pomůcky použít) a jak se zachovat v případě nehody.
Ochranné pomůcky
- chemický plášť – Bavlněný (neochotně hoří), bílý (je na něm vidět potřísnění), zapíná se na knoflíky (v případě nutnosti jej lze strhnout).
- štít/brýle – Chrání obličej či oči. Oči jsou značně náchylné na poškození a mohou jimi vnikat do organismu nebezpečné látky.
- rukavice – Chrání ruce, vyrábějí se např. z latexu, PVC či nitrilu.
- dýchací maska – Mnohdy s výměnnými filtry, které zachytávají určité nebezpečné látky a zabraňují jejich vdechnutí.
Označování chemických látek a směsí
Chemické látky či směsi bývají (v souladu se systémem GHS) dodávány s bezpečnostním listem, který obsahuje informace o nakládání s nimi. Nebezpečnost látek/směsí na obalu může být stručně vyjádřena signálním slovem (VAROVÁNÍ, NEBEZPEČÍ). P-věty (z anglického precaution) informují o bezpečném nakládání, H-věty (z anglického hazard) popisují nebezpečí.
Látky bývají též označené symboly nebezpečí:
| Symbol nebezpečí | Význam | Příklad(y) |
|---|---|---|
 |
žíravé/korozivní látky | kyseliny (např. kyselina sírová), hydroxidy (např. hydroxid sodný určený k čištění odpadu) |
 |
plyny pod tlakem | oxid uhličitý v tlakové lahvi |
 |
dráždivé látky | aceton, prostředek na mytí nádobí |
 |
výbušné látky – uvolňují najednou velké množství plynů | nitroglycerin, TNT, zábavní pyrotechnika |
 |
hořlavé látky | benzín, deodorant ve spreji |
 |
látky nebezpečné pro životní prostředí | pentahydrát síranu měďnatého, dimethylrtuť, čistič WC |
 |
oxidující látky – způsobují či zesilují požár/výbuch | peroxid vodíku, chlornan sodný |
 |
látky nebezpečné pro zdraví – vyvolávají dlouhodobé poškození organismu | benzen (např. v rozpouštědle barev), kadmium |
 |
jedovaté (toxické) látky – způsobují smrt či poškození zdraví (akutní toxicita) | nikotin, kyanovodík |
Nebezpečné látky/směsi v běžném prodeji (např. čisticí prostředky) musejí též být opatřeny bezpečnostním uzávěrem a/nebo haptickou informací (obvykle vyvýšený rovnostranný trojúhelník).
První pomoc
- První pomocí při potřísnění kyselinou/hydroxidem je omývání postiženého místa vodou.
- Popáleniny je namístě chladit, případně sterilně překrýt.
- Při požití jiných látek či kontaktu s nimi je vhodné jednat podle instrukcí na obalu/v bezpečnostním listu, případně volat Toxikologické informační středisko či zdravotnickou záchrannou službu.
Voda: základy a koloběh
Voda je sloučenina vodíku a kyslíku. Popisuje se vzorcem \mathrm{H_2O}, každá její molekula obsahuje dva atomy vodíku (\mathrm{H}) a jeden atom kyslíku (\mathrm{O}). Na Zemi se voda vyskytuje ve třech skupenstvích (pevné – led, kapalná voda, plynné – vodní pára).
Fyzikální vlastnosti vody
Kapalná voda má při 20 °C hustotu 0,998 g/cm³. Běžný led má hustotu asi 0,917 g/cm³, což je méně než u kapalné vody (led tedy plave na její hladině). Největší hustotu (prakticky 1 g/cm³) má kapalná voda při 3,95 °C, voda o této teplotě tedy např. v zimě klesá ke dnu a umožňuje přežití organismů ve vodních tělesech (jezerech, rybnících aj.).
Teplota tání vody za standardního tlaku je 0 °C, teplota varu 100 °C (při varu se voda vypařuje v celém svém objemu). Teplota varu se s klesajícím tlakem (např. při výstupu do vyšších nadmořských výšek) snižuje. Led může sublimovat (přecházet rovnou do plynného skupenství), kapalná voda se ze svého povrchu vypařuje i při teplotě nižší, než je teplota varu.
Voda v živých organismech
Voda je klíčové rozpouštědlo pro pozemský život. V živých organismech je součástí buněk (případně i mezibuněčné hmoty), podílí se na transportu látek či tvoří prostředí pro funkci enzymů.
Koloběh vody v přírodě
Kondenzace (kapalnění) vodní páry v atmosféře vede ke vzniku oblačnosti a srážek (např. deště, krup, sněhu, mlhy). Voda, která se dostane na povrch, se opět vypařuje, prosakuje do země nebo je vodními toky vedena do moří a oceánů.
Voda v mořích a oceánech obsahuje rozpuštěné soli, které původně byly přítomné v horninách. Při odpařování slané vody se odpařuje jen voda (\mathrm{H_2O}) bez solí, oblaky tedy sestávají ze sladké vody.
Podzemní voda vyplňuje dutiny a pukliny v horninách. Vzhledem k tomuto těsnému kontaktu je u ní vyšší pravděpodobnost mineralizace a např. nasycení oxidem uhličitým.
Voda a rozpuštěné minerální látky
Voda se v přírodě nevyskytuje chemicky čistá, obsahuje určité množství rozpuštěných minerálních látek (solí).
Tvrdá voda obsahuje větší množství rozpuštěných minerálních látek (zejména \mathrm{CaO} a \mathrm{MgO}), měkká voda méně. Většina vody na Zemi (asi 97 %) je slaná. Množství rozpuštěných solí ve vodě (zvláště mořské) se označuje jako salinita.
Destilovaná voda je destilací (vypařením a kondenzací) zbavená minerálních látek.
NahoruVyužívání vody
Voda se využívá k přímé konzumaci (pití), při výrobě potravin či vaření, v zemědělství, průmyslu či energetice (např. pro chlazení jaderných reaktorů).
Typy vody podle využití
- Pitná voda je vhodná ke konzumaci. Musí splňovat hygienické normy, je zbavená nečistot a mikroorganismů. Vodovodním řadem v Česku se rozvádí právě pitná voda.
- Užitková voda se používá v průmyslu či zemědělství.
- Využitím a znečištěním pitné či užitkové vody vzniká voda odpadní.
Jako minerální se označuje podzemní voda stálého složení a vlastností, může být do různé míry mineralizovaná.
Úprava pitné vody
K získání pitné vody se používají jak podzemní, tak povrchové vody. Ty je obvykle nutné vyčistit. Obecně stálejší je složení a kvalita podzemních vod, kvalita vod povrchových se může rychleji měnit. Při úpravě pitné vody se používají např. následující procesy:
- usazování v usazovacích nádržích – Odstraňování hrubších částic (kalu).
- čiření – Vlivem přidání chemických činidel probíhá vločkování (flokulace) nečistot, které pak lze snáze odfiltrovat.
- filtrace – Např. přes křemelinu či písek.
- oxidace a dezinfekce – Odstraňuje organické látky, mikroorganismy i některé anorganické látky. Používají se např. sloučeniny chloru (chlorace), ozon (\mathrm{O_3}, ozonizace) či UV záření.
- provzdušňování – Odstraňuje zapáchající plyny (např. amoniak – \mathrm{NH_3} či sulfan – \mathrm{H_2S}), převádí ionty železa do nerozpustné formy.
V Česku je pitná voda obecně zdravotně nezávadná, má tedy smysl upřednostnit pití kohoutkové vody před vodou balenou.
Vodní kámen
Vodní kámen sestává z krystalizovaných minerálních látek, zejména uhličitanu vápenatého (\mathrm{CaCO_3}). Tvoří se hlavně ve spojitosti s tvrdou vodou, např. ve varných konvicích, na topných tělesech praček, v bojlerech apod. K jeho vyčištění lze využít rozpuštění kyselinami (např. octovou, citronovou). V případě, že je do domácnosti přiváděna tvrdá voda, je možnost využít změkčovadla.
Čistírny odpadních vod
Čistírny odpadních vod (ČOV, lidově „čističky“) provádějí čištění odpadních vod z obcí (splašková/komunální odpadní voda) nebo jsou budované v blízkosti průmyslových provozů. Odpadní vody by jimi před vypuštěním do přírody měly projít.
V komunálních čistírnách obvykle probíhají tyto procesy:
- mechanické čištění – Odstraňování písku a nerozpustných nečistot přes štěrk a česle či síta. Usazování.
- biochemické čištění – Využívá bakterií a dalších (mikro)organismů, které rozkládají organické látky a využívají minerální látky (např. dusík, fosfor). Mrtvé organismy a další částice se usazují jako kal, z toho může být tvořen např. bioplyn či může být použit jako hnojivo.
Při vyšších požadavcích na kvalitu vypouštěné vody může následovat i chemické čištění, např. k vysrážení zbylých sloučenin fosforu.
Vodní stopa
Jako vodní stopa se označuje množství vody využité jedinci či skupinami lidí, a to jak k osobnímu využití (hygiena, pití aj.), tak k výrobě zboží či poskytování služeb. Zahrnuje vodu, u níž dojde ke znečištění či vypaření za určitý čas.
NahoruVzduch: základy
Vzduch je směs, která se skládá především z plynů. Může obsahovat i kapaliny (např. kapky vody tvořící mlhu) a pevné látky (např. prach, popílek, mikroorganismy, spory, pyl). Vzduch tvoří atmosféru, je důležitý pro existenci živých organismů. Následující tabulka uvádí zásadní plynné složky vzduchu:
| Plyn | Vzorec | Objem v suchém vzduchu | Další informace |
|---|---|---|---|
| dusík | \mathrm{N_2} | 78 % | Za standardních podmínek víceméně nereaktivní. |
| kyslík | \mathrm{O_2} | 21 % | Zásadní pro buněčné dýchání. |
| argon | \mathrm{Ar} | 0,93 % | Nereaktivní vzácný plyn. |
| oxid uhličitý | \mathrm{CO_2} | 0,04 % | Výchozí látka fotosyntézy, uvolňuje se např. při dýchání, spalování fosilních paliv či sopečné činnosti. Jeho množství v atmosféře v současnosti stoupá. |
Jednotlivé složky lze oddělit frakční destilací zkapalněného vzduchu. Množství vodní páry (\mathrm{H_2O}) ve vzduchu je proměnlivé, kolísá zhruba od 0,2 do 4 %.
NahoruZnečištění ovzduší
Ovzduší může být znečištěno jak přírodními procesy (např. vulkanická aktivita), tak činností člověka. Znečišťující složky se ve vzduchu nacházejí obvykle v relativně malém množství (ve srovnání s celkovým objemem vzduchu), přesto mohou mít na kvalitu ovzduší značný vliv.
Příklady znečišťujících látek, znečištění vnějšího prostředí
Zdraví člověka či živé organismy může ohrožovat například:
- oxid uhelnatý (\mathrm{CO}) – Vzniká při nedokonalém spalování (zejména za nedostatku kyslíku).
- přízemní ozon (\mathrm{O_3}) – Ozon se přirozeně vyskytuje ve stratosféře, kde jeho vznik omezuje pronikání UV záření na povrch Země. V blízkosti zemského povrchu je však škodlivý, jedná se o silné oxidační činidlo.
- některé freony (uhlovodíky obsahující \mathrm{F}/\mathrm{Cl}) – Dříve užívané jako hnací látky a chladiva, což vedlo ke zmenšování ozonové vrstvy a vzniku ozonové díry. Po jejich zákazu se stav ozonosféry pozvolna obnovuje.
- oxid siřičitý (\mathrm{SO_2}) – Vzniká při spalování fosilních paliv obsahujících síru. Dříve způsoboval kyselé deště. V současnosti se provádí odsiřování uhelných elektráren, díky čemuž lze mj. získat energosádrovec využitelný ve stavebnictví.
- oxidy dusíku (\mathrm{NO}_x) – Obvykle značně jedovaté, vznikají zejména ve spalovacích motorech a podporují vznik přízemního ozonu. Při hodnocení kvality vzduchu se obvykle posuzuje oxid dusičitý (\mathrm{NO_2}).
- polycyklické aromatické uhlovodíky (např. benzo[a]pyren) – Vznikají obecně při hoření (např. v rámci kouření tabákových výrobků, spalování paliva v motorech, topení v kotlích na tuhá paliva). Zvyšují riziko zhoubných nádorů (jsou karcinogenní), způsobují mutace.
Pevné částice (např. prach, saze) se označují zkratkou PM (particulate matter), za tu se uvádí velikost částic v μm (např. PM10, PM2,5).
Dopravní prostředky se spalovacími motory musejí být vybaveny katalyzátory a případně filtry pevných částic, což zajišťuje zmenšení negativního vlivu na ovzduší (více v kapitole pohonné hmoty, doprava).
Znečištění ovzduší chemickými látkami se označuje jako smog (kombinace slov smoke a fog). Vypouštěné znečišťující látky jsou emise, pokud dojde k jejich přenesení na jiné místo, hovoří se o imisích.
Skleníkové plyny
Skleníkové plyny mohou prohlubovat klimatickou změnu. Patří mezi ně např. oxid uhličitý (\mathrm{CO_2}) či methan (\mathrm{CH_4}). Těmto plynům se věnuje kapitola klimatická změna. Např. \mathrm{CO_2} se obvykle nepovažuje za „znečišťující“ látku, je ve vzduchu v určité míře obsažen přirozeně.
Znečištění ovzduší uvnitř budov
Ovzduší může být znečištěno jak ve venkovním prostředí, tak uvnitř budov. Do vnitřního ovzduší se mohou dostávat třeba látky z nábytku (např. formaldehyd) či uskladněných chemikálií (např. čisticích prostředků, rozpouštědel aj.). Kouření či používání elektronických cigaret uvnitř budov vede k tomu, že vzniklé látky zde setrvávají delší dobu a také delší dobu ohrožují zdraví.
Kouření obecně je zdrojem řady (až tisíců různých) škodlivých látek, které zvyšují mj. riziko onemocnění cévní soustavy či zhoubných nádorů.
Vliv kouření na kuřáka a okolí
Kouření ohrožuje zdraví kuřáků samotných. Jedná se zároveň o činnost bezohlednou k okolí: v případě přítomnosti dalších lidí tito lidé pasivně vdechují škodliviny. Na léčbu chorob přímo podmíněných kouřením jsou vynakládány značné prostředky z veřejného zdravotního pojištění (nekuřáci tedy mnohdy platí za nezodpovědnost kuřáků).
Vzduchem může procházet neviditelné ionizující záření. To vzniká např. radioaktivní přeměnou plynu radonu (\mathrm{Rn}), který je sám produktem radioaktivní přeměny uranu. Přítomnost radonu je vhodné zjistit např. při nájmu, koupi či stavbě nemovitosti.
NahoruSložení lidského těla: přehled
Lidské tělo se skládá z anorganických i organických látek. Organické látky jsou zpravidla složitější sloučeniny uhlíku (\mathrm{C}), ten je základem biomolekul v rámci pozemského života. Projevy života jsou pak podmíněné neustálým cíleným průběhem chemických reakcí a přenosem energie a látek v rámci těla.
Tipy k procvičování
Tato kapitola poskytuje hlavně základní přehled o skupinách látek v těle a o metabolismu. Podrobnější informace a procvičování jsou k dispozici na odkazech uvedených dále.
Anorganické látky
Mezi anorganické látky v lidském těle patří například voda (\mathrm{H_2O}). Anorganické jsou též dýchací plyny, kyslík (\mathrm{O_2}) a oxid uhličitý (\mathrm{CO_2}). Látky, které přijímáme ve formě iontů/solí, se také označují jako minerální látky, např. sodík (jako ionty \mathrm{Na^+}), draslík (ionty \mathrm{K^+}), vápník (ionty \mathrm{Ca^{2+}}).
Organické látky
Mezi základní živiny patří:
- sacharidy (mezi ty patří i jednoduché cukry) – Zejména rychlejší zdroj energie.
- tuky – Bohatý zdroj energie, ochrana orgánů, udržování tepla.
- proteiny = bílkoviny – Stavební látky, součást enzymů (díky nim cíleně probíhají chemické reakce) či některých hormonů, podílejí se na imunitě. Lidské tělo si tvoří vlastní bílkoviny z aminokyselin na základě „návodu“ ve své DNA.
Vitaminy jsou v malém množství potřeba pro fungování metabolických procesů.
Hormony jsou látky podílející se na řízení těla (vytvářejí se v něm), mohou být bílkovinné povahy nebo vycházet z látky cholesterolu.
Nukleotidy jsou látky, z nichž se skládají nukleové kyseliny (DNA, RNA). Tělo je získává z potravy, dokáže si je i vytvořit.
$1ism$2$3
Přeměna látek a energií v těle živých organismů se označuje jako metabolismus. Látky lidské tělo přijímá za účelem růstu, přestavby tkání či získávání energie. Naopak vylučuje odpadní látky či látky, které přijalo, ale jsou pro něj škodlivé. Metabolické děje probíhají typicky uvnitř buněk, mohou ale probíhat i mimo mě (např. enzymy štěpí živiny uvnitř orgánů trávicí soustavy).
Přijímáme a vylučujeme jak látky anorganické (kyslík, voda, minerální látky), tak organické (živiny v užším smyslu: sacharidy, tuky, proteiny; vitaminy).
Určité části těla zpravidla provádějí určitý typ metabolických přeměn nebo jsou uzpůsobené přijímání/zbavování se určitých látek:
- dýchací soustava – Pomocí ní se do těla dostávají a z něj odcházejí plyny: cíleně přijímá kyslík (\mathrm{O_2}) a odstraňuje z těla oxid uhličitý (\mathrm{CO_2}).
- trávicí soustava – Přijímá a zpracovává živiny, vylučuje nestrávené zbytky a látky rozpustné v tucích.
- vylučovací soustava a kůže – Vylučuje vodu a látky rozpustné ve vodě.
Anorganické látky v lidském těle
Lidské tělo kromě organických látek (složitějších sloučenin uhlíku, např. sacharidů, tuků a proteinů) obsahuje i látky anorganické. Tělo z nich přímo nezískává energii, ale mohou sloužit jako stavební látky či umožňovat činnost organismu.
Voda v lidském těle
Voda (\mathrm{H_2O}) je hlavním rozpouštědlem pro pozemský život. Tvoří asi 60 % hmotnosti těla dospělého člověka. Podílí se na transportu látek, rozvádění tepla, je prostředím pro funkci enzymů (ve vodném prostředí probíhá většina chemických reakcí v těle). Vodu přijímáme jako součást jídla a také pitím, bývají v ní rozpuštěné minerální látky. Kromě toho voda vzniká i v rámci metabolismu (např. jako produkt buněčného dýchání).
Dýchací plyny
Mezi hlavní dýchací plyny patří kyslík (\mathrm{O_2}) a oxid uhličitý (\mathrm{CO_2}). Jejich transport do těla/z něj zajišťuje hlavně dýchací soustava.
- Kyslík je výchozí látkou buněčného dýchání (je pro něj potřeba). Reakcí živin (hlavně sacharidů a tuků) s kyslíkem v buňkách se uvolňuje využitelná energie.
- Oxid uhličitý vzniká při buněčném dýchání. Uhlík (\mathrm{C}), který je v něm obsažený, se původně nacházel ve zpracovaných živinách.
Minerální látky
Jako minerální látky se označují anorganické látky nebo prvky, které obvykle přijímáme ve formě solí/iontů.
- železo (\mathrm{Fe}) – Podílí se na přenosu kyslíku krví, je součástí hemoglobinu v červených krvinkách.
- vápník (\mathrm{Ca}, třeba ve formě uhličitanu vápenatého – \mathrm{CaCO_3}) – Tvoří kosti a zuby. Ionty zásadní pro stahy svalů.
- fosfor (\mathrm{P}, třeba ve formě fosforečnanů – \mathrm{PO_4^{3-}}) – Tvoří kosti a zuby, součástí sloučenin krátkodobě uchovávajících energii (ATP), součástí nukleových kyselin (např. DNA).
- sodík (ve formě sodného kationtu – \mathrm{Na^+}), draslík (draselné kationty – \mathrm{K^+}), hořčík (hořečnaté kationty – \mathrm{Mg^{2+}}), chlor (chloridové anionty – \mathrm{Cl^-}) – V tělních tekutinách. Podílejí se např. na přenosu nervových vzruchů.
- jod (\mathrm{I}) – Součástí hormonů štítné žlázy.
- Různé stopové prvky, např. zinek (\mathrm{Zn}), selen (\mathrm{Se}) nebo měď (\mathrm{Cu}), jsou nutné pro funkci enzymů.
Dusík (\mathrm{N}) je součástí nukleových kyselin nebo aminokyselin. Odstraňuje se vylučovací soustavou hlavně ve formě močoviny.
NahoruStavební materiály
Stavební materiály se používají pro konstrukci budov a dalších staveb. Tato kapitola přibližuje hlavně materiály, jejichž výroba vychází z minerálů/hornin nacházejících se v litosféře Země.
Vápno
- Zásadní pro výrobu stavebních hmot je těžba vápence. Ten obsahuje minerál kalcit, uhličitan vápenatý – \mathrm{CaCO_3}.
- Pálením vápence se získává pálené vápno, oxid vápenatý – \mathrm{CaO}. Tento proces lze popsat chemickou rovnicí takto: \mathrm{CaCO_3 \longrightarrow CaO + CO_2}.
- Reakcí páleného vápna s vodou vzniká hašené vápno, hydroxid vápenatý – \mathrm{Ca(OH)_2}.
- Hašené vápno ve stavební hmotě tuhne díky reakci se vzdušným oxidem uhličitým, vznikne opět pevný uhličitan vápenatý: \mathrm{Ca(OH)_2 + CO_2 \longrightarrow CaCO_3 + H_2O}.
Smícháním páleného vápna, vody a písku vzniká vápenná malta, tu lze použít ke spojování cihel/tvárnic či vytváření omítek. Malta může místo páleného vápna ale obsahovat i cement (cementová malta), vizte dále.
Cement a beton
Cement (respektive běžný portlandský cement) obsahuje kromě oxidu vápenatého (\mathrm{CaO}) i další oxidy, například oxid křemičitý (\mathrm{SiO_2}), hlinitý (\mathrm{Al_2O_3}) nebo železitý (\mathrm{Fe_2O_3}). Vyrábí se pálením vápence společně s příměsemi, jejich množství ovlivňuje vlastnosti vznikajícího cementu.
Při tuhnutí portlandského cementu se uplatňuje reakce oxidů s vodou (hydratace). Vzniklý hydroxid vápenatý pak může reagovat se vzdušným oxidem uhličitým (obdobně jako u vápna).
Smícháním cementu, vody a kameniva (písku, štěrku) vzniká beton (respektive cementový beton). Ten se používá např. pro výrobu nosných konstrukcí či panelů.
Sádra
Sádra (hemihydrát síranu vápenatého – \mathrm{CaSO_4 \cdot \frac{1}{2}\,H_2O}) se vyrábí pálením minerálu sádrovce (dihydrát síranu vápenatého – \mathrm{CaSO_4 \cdot 2\,H_2O}). Tento proces tedy vlastně zajišťuje odstranění vody z krystalické mřížky. Rozmícháním sádry ve vodě opět vzniká pevný sádrovec. Sádra se používá např. pro drobné opravy zdí, při výrobě sádrokartonu, modelů a soch či k fixaci zlomenin.
Sádrovec (respektive energosádrovec) je produktem odsiřování kouřových plynů, např. z tepelných elektráren.
Sklo
Sklo je amorfní materiál (jeho struktura není krystalická). Základní látkou pro výrobu skla je oxid křemičitý (\mathrm{SiO_2}), který je přítomen ve sklářském písku. Běžným typem skla je sodnovápenaté sklo, při výrobě se ke sklářskému písku přidává soda (\mathrm{Na_2CO_3}), která snižuje teplotu tání směsi, a vápenec (\mathrm{CaCO_3}). Při výrobě skla se používá i sklo získané tříděním odpadu, sklo lze prakticky donekonečna recyklovat.
Kovy
Ve stavebnictví se používají i mnohé kovy. Uplatnění má železo (např. jako výztuž do železobetonu), korozivdorná ocel či hliník (např. k výrobě okenních profilů).
NahoruVybavení kuchyně
Nádobí
Mnohé nádobí je vyrobeno ze skla. Běžné sodnovápenaté sklo se v základu vyrábí ze sklářského písku, vytříděného starého skla, sody (uhličitanu sodného, \mathrm{Na_2CO_3}) a uhličitanu vápenatého (\mathrm{CaCO_3}). Borosilikátové sklo (varné sklo) odolává změnám teplot (má nízkou tepelnou roztažnost), jsou z něj např. varné konvice. Při jeho výrobě se používá oxid boritý (\mathrm{B_2O_3}).
Porcelán se vyrábí z horniny kaolinu, ostřiva (oxidu křemičitého, \mathrm{SiO_2}) a taviva (živec).
Hrnce, pánve nebo příbory mohou být z korozivzdorné (nerezové) oceli. Ta kromě železa (\mathrm{Fe}) obsahuje např. chrom (\mathrm{Cr}), nikl (\mathrm{Ni}) nebo molybden (\mathrm{Mo}). Litina sestává ze železa s větším podílem uhlíku (\mathrm{C}). Litina má značnou tepelnou kapacitu, pomalu se nahřívá, ale na druhou stranu i delší dobu udrží teplo. Povrch litinového nádobí bývá smaltovaný, aby pokrm nepřišel do přímého kontaktu s kovem. Výbornou tepelnou vodivost v rámci nádobí má měď (\mathrm{Cu}) či hliník (\mathrm{Al}).
Nepřilnavý povrch nádobí bývá zhotoven z teflonu (PTFE, polytetrafluorethen). Jde o polymer obsahující atomu uhlíku a fluoru. Je tepelně odolný asi do 260 °C, odpuzuje vodu a má nízké tření. Mezi nevýhody patří jeho výroba zatěžující životní prostředí. Teflon také není příliš mechanicky odolný, časem se jeho drobné částice začínají uvolňovat do jídla. Narušování teflonového povrchu dále urychluje např. kontakt s kovovými nástroji či příbory.
Nádobí může být vyrobeno též z plastu. Běžné plasty (např. polyethylen – PE, polypropylen – PP) nejsou příliš teplotně odolné (proto by neměly přicházet do kontaktu s horkými potravinami a nápoji), snadno dochází k narušení jejich povrchu a uvolňování mikroplastů do jídla. Nástroje odolnější vysokým teplotám (např. obracečky) bývají vyrobené z polyamidů, jejich výhodou je, že neničí povrchy nádob.
Dalším materiálem pro výrobu nádobí a nástrojů je silikon, který v základu obsahuje řetězec atomů křemíku (\mathrm{Si}) a kyslíku (\mathrm{O}) s navázanými organickými skupinami.
Mytí nádobí, čištění povrchů
Mycí a čisticí prostředky se obecně označují jako detergenty. Patří mezi ně zejména tenzidy, ty snižují povrchové napětí vody. Jsou schopné na sebe vázat vodu i látky rozpustné v tucích (nečistoty). Např. do tablet do myčky se často přidávají i enzymy, které štěpí zbytky jídla. Použitím teplé vody se zvyšuje rychlost chemických reakcí i fyzikálních dějů, a tím i efektivita mytí.
Pro čištění povrchů se používá např. tekutý písek. Ten obsahuje částice oxidu křemičitého, které mechanicky narušují nečistoty.
Vodní kámen vzniká usazováním (krystalizací) uhličitanu vápenatého (\mathrm{CaCO_3}) na površích. Ten lze odstranit pomocí kyselých roztoků (např. octa, kyseliny citronové). Naopak usazené organické taniny (např. hnědý povlak u nádobí určeného na čaj) efektivně odstraní třeba roztok jedlé sody (\mathrm{NaHCO_3}), který zajistí zásadité prostředí a navíc také funguje jako abrazivum.
NahoruLátky v potravinách
Toto téma přibližuje různé látky spjaté s potravinami. Další kontext (zdůrazňující např. základní živiny, látky v lidském těle a vliv na něj) je k dispozici v kapitole výživa a metabolismus.
Anorganické látky v potravinách
Běžná kuchyňská sůl obsahuje hlavně chlorid sodný (\mathrm{NaCl}). Do soli se běžně přidávají sloučeniny jodu (např. jodičnan draselný – \mathrm{KIO_3}), aby nedocházelo k jeho nedostatku v souvislosti s funkcí štítné žlázy.
Kypřicí prášky uvolňují plyny, které způsobí nakynutí těsta. Některé kypřicí prášky jsou založené na tepelném rozkladu solí (např. hydrogenuhličitanu amonného – \mathrm{NH_4HCO_3}, vzniká amoniak a oxid uhličitý). Další způsob kypření je založen na reakci kyselin (např. kyselina vinná, fosforečnany) a zásad (hydrogenuhličitan sodný, jedlá soda – \mathrm{NaHCO_3}).
Oxid uhličitý (\mathrm{CO_2}) se používá pro sycení nápojů.
Oxid dusný (\mathrm{N_2O}, lidově rajský plyn) se používá v gastronomii jako hnací plyn ve šlehačkových bombičkách.
Zlato (\mathrm{Au}) lze použít jako dekoraci, zvláště u luxusních zákusků. Vzhledem k jeho netečnosti beze změny projde lidským tělem.
Přídatné látky
Přídatné látky se popisují určitými kódy (např. E211), lidově se označují jako „éčka“. V potravinách plní různé funkce.
Konzervanty zabraňují růstu mikroorganismů a prodlužují trvanlivost potraviny. Příkladem je benzoan sodný. Do uzenin se přidávají dusitany (zejména dusitan sodný, \mathrm{NaNO_2}). Ty zastavují množení bakterií a zároveň rozklad hemoglobinu, čímž udržují barvu masa.
Emulgátory umožňují mísení složek rozpustných ve vodě a v tucích. Příkladem je sójový či slunečnicový lecitin.
Antioxidanty zpomalují reakci se vzdušným kyslíkem a prodlužují trvanlivost potravin. Příkladem je kyselina askorbová (vitamin C).
Barviva dodávají potravinám požadovanou barvu, patří mezi ně např. β-karoten.
Chuť a vůně potravin
- Sladkou chuť v základu způsobují jednoduché sacharidy (cukry). Může být ale vyvolána i umělými sladidly (např. aspartam, acesulfam K, glykosidy ze stévie sladké).
- Kyselá chuť souvisí s kyselým charakterem potravin, kdy je v roztoku nízké pH a vyšší koncentrace vodíkových kationtů (\mathrm{H^+}). Kyselou chuť způsobuje např. kyselina citronová či askorbová.
- Slaná chuť je vyvolána přítomností solí (zejména chloridu sodného, \mathrm{NaCl}).
- Hořkou chuť způsobují hlavně rostlinné alkaloidy.
Mezi další chutě patří např. chuť umami, která je způsobená glutamáty (solemi kyseliny glutamové, což je aminokyselina).
Chuť a vůni potravin ovlivňují i aromata, například syntetický ethylvanilin nahrazuje vanilkovou chuť přírodního methylvanilinu a dalších chuťových složek vanilky.
NahoruReakce v kuchyni, příprava jídla
Ohřev
Běžným zdrojem tepla je hoření zemního plynu. Ten se skládá převážně z methanu (\mathrm{CH_4}). Jeho hořením vzniká oxid uhličitý (\mathrm{CO_2}) a voda (\mathrm{H_2O}). Aby byl zemní plyn v případě úniku cítit, odorizuje se (např. pomocí thiolů).
Indukční varné desky pomocí magnetického pole vyvolávají vířivé proudy ve dnu nádoby, což způsobuje ohřev. S indukčním ohřevem je kompatibilní nádobí s (fero)magnetickým dnem (obvykle obsahující železo).
K odstraňování par a pachů při vaření slouží digestoř. V digestořích bývá tukový filtr (často z hliníku) a filtr obsahující aktivní uhlí (\mathrm{C}).
Fyzikální a chemické děje v kuchyni
Při varu se kapalina mění na plyn v celém svém objemu. Difuze je přechod látky z prostředí s vyšší koncentrací do prostředí s nižší koncentrací (např. louhování čaje). Z hlediska oddělování složek směsí se v kuchyni často uplatňuje filtrace (např. slévání těstovin, příprava kávy). Ochlazení potravin v lednici či jejich zmrazení zpomalí průběh chemických reakcí v nich, tudíž se uchovají déle čerstvé.
Reakce související s jídlem, bezpečnost
Při ztužování tuků se mění kapalné tuky (oleje) na pevné. Dochází k sycení dvojných vazeb v mastných kyselinách vodíkem (\mathrm{H_2}) a jejich přeměně na vazby jednoduché.
Pokud vystavíme bílkoviny teplu, dojde ke změně jejich prostorového uspořádání neboli denaturaci. Příkladem je tepelná úprava vajec či masa.
Při vysokých teplotách vznikají karcinogenní (rakovinotvorné) látky, např. akrylamid nebo polycyklické aromatické uhlovodíky (PAHs). Proto je vhodné potraviny nepřipalovat. Při grilování vzniku těchto nebezpečných látek do určité míry může zabránit marinování masa.
Fermentace (kvašení) je přeměna cukrů (sacharidů) na alkohol (ethanol) nebo kyseliny (např. kyselina mléčná). Uplatňuje se třeba při výrobě jogurtů či kynutí pečiva za účasti kvasinek.
Maillardova reakce je zodpovědná za hnědnutí potravin např. při pečení, též při ní vznikají látky ovlivňující chuť a vůni. Reagují při ní sacharidy s aminokyselinami. Typicky probíhá při pečení pečiva nebo pražení kávy.
Rozpouštědla a povrchově aktivní látky
Rozpouštědla
Rozpouštědla rozpouštějí jiné látky. Tvoří s jinými látkami tvoří stejnorodé (homogenní) směsi neboli roztoky, aniž by s nimi chemicky reagovaly. Rozpouštědla jsou zpravidla kapaliny, při vytváření roztoku jsou obvykle ve srovnání s rozpouštěnou látkou v nadbytku.
Běžně používaná rozpouštědla lze rozdělit na polární a nepolární:
- Mezi typická polární rozpouštědla patří voda či ethanol. Polární rozpouštědla mají nerovnoměrně rozložený náboj v molekulách (např. vlivem rozdílných elektronegativit atomů). Polární rozpouštědla zpravidla dobře rozpouštějí soli a jiné polární/iontové látky.
- Nepolární rozpouštědla mají rovnoměrně rozložený náboj v molekulách. Typickým příkladem jsou uhlovodíky, v jejich molekulách je malý rozdíl elektronegativit v rámci vazeb \mathrm{C–C} nebo \mathrm{C–H}. Patří mezi ně např. benzen, toluen, petrolej (směs uhlovodíků) nebo tetrachlorethen. Nepolární rozpouštědla zpravidla dobře rozpouštějí jiné nepolární látky.
Příklady
- Voda je polární rozpouštědlo. Bude tedy dobře rozpouštět např. chlorid sodný (\mathrm{NaCl}), který má iontový charakter.
- Molekuly oleje jsou víceméně nepolární. V oleji se tedy bude ochotně rozpouštět např. červené barvivo β-karoten či z něho vznikající vitamin A.
Povrchově aktivní látky
Povrchově aktivní látky se označují jako tenzidy. Snižují povrchové napětí rozpouštědel. Používají se v pracích a čisticích prostředcích, typickým příkladem tenzidu je mýdlo. Molekuly tenzidů obsahují zároveň polární (hydrofilní) a nepolární (hydrofobní) část, dokážou se tedy mísit s polární látkou (typicky vodou) i nepolárními látkami (typicky tuky, nečistotami).
NahoruKoupelna, kosmetika
Vybavení koupelny
Např. umyvadlo či záchodová mísa bývají vyrobené z keramiky. Základním materiálem pro jejich výrobu je tedy hornina kaolin. Na povrchu bývá hladká glazura (v základu z oxidu křemičitého – \mathrm{SiO_2}), která zajistí chemickou odolnost a snadné čištění.
Vodovodní baterie bývají mnohdy pokovované chromem (\mathrm{Cr}).
K výplni spár se používají silikony, ty obsahují řetězce atomů křemíku (\mathrm{Si}) a kyslíku (\mathrm{O}) s navázanými organickými skupinami.
Zrcadla fungují díky přítomnosti tenké odrazivé vrstvy hliníku (\mathrm{Al}), případně stříbra (\mathrm{Ag}).
Ručníky a osušky se typicky vyrábějí z bavlny, sestávají tedy hlavně z polysacharidu celulózy.
Čisticí prostředky
Pro zprůchodnění zaneseného odpadu lze využít žíravý hydroxid sodný (\mathrm{NaOH}), který rozloží např. vlasy, zbytky kůže aj.
Vodní kámen (tvořený hlavně uhličitanem vápenatým – \mathrm{CaCO_3}) se rozpouští v kyselém prostředí, které lze zajistit např. použitím kyseliny octové (octa).
Některé čisticí prostředky (např. Savo) obsahují jako aktivní látku chlornan sodný (\mathrm{NaClO}). Ten má oxidační a bělicí účinky. Není vhodné ho používat společně s dalšími prostředky (zejména kyselými), mohlo by docházet k uvolňování jedovatého chloru (\mathrm{Cl_2}).
Další čisticí prostředky jsou založené na přítomnosti povrchově aktivních látek. Některé používají i abrazivní částice (ty obrušují nečistoty, např. v tekutém písku).
Mýdlo, šampon
Mýdlo i šampon obsahují povrchově aktivní látky. Část molekuly těchto látek se ochotně mísí s vodou (je hydrofilní), část s tuky a nečistotami (je hydrofobní). V mýdlech se typicky používají sodné soli mastných kyselin, v šamponech třeba laurethsulfát sodný (SLS/SLES). V mýdlech a šamponech typicky bývají i látky způsobující vůni (např. geraniol, citral, linalool, limonen) a barviva (např. brilantní modř – Cl 42 090).
Pěna a povrchově aktivní látky
Přítomnost pěny nutně neznačí, že povrchově aktivní látka funguje (lépe). Spotřebitelé tomuto však mnohdy věří. Proto se do různých drogeristických výrobků přidávají látky zdůrazňující pěnění kvůli psychologickému efektu na spotřebitele.
Čištění zubů
Zubní pasty v základu obvykle obsahují částice schopné obrušovat nečistoty ze zubů, zpravidla hydratovaný oxid křemičitý. Dále zde bývá přítomen zdroj fluoridových iontů (\mathrm{F^-}, např. fluorid sodný – \mathrm{NaF}), které remineralizují sklovinu a činí ji odolnější vůči působení kyselin. Zubní kartáčky se nejčastěji zhotovují z polypropylenu (PP) či polyethylenu (PE), vlákna pak bývají z nylonu.
Praní
Prací prášky, podobně jako další výrobky určené k čištění, obsahují hlavně povrchově aktivní látky (tenzidy) a látky změkčující vodu, které funkci tenzidů usnadňují (např. soli kyseliny fosfonové, EDTA). Dále bývají přítomné enzymy, které rozkládají proteiny, sacharidy a tuky. Nacházet se zde mohou i bělidla či optické zjasňovače.
Kosmetika a další výrobky
- Antiperspiranty často zabranují pocení díky tomu, že působením hlinitých kationtů (\mathrm{Al^{3+}}) uzavírají póry v kůži.
- Rtěnky v základu obsahují vosk či parafín, v němž jsou barviva.
- Řasenky zvýrazňují řasy např. díky obsahu amorfnímu uhlíku (\mathrm{C}) či oxidům železa.
- Odlakovače na nehty typicky jakožto rozpouštědlo používají ethylester kyseliny octové (ethyl-ethanoát).
Plast (umělá hmota) je uměle vyrobený materiál. Plasty jsou organické sloučeniny, jejich molekuly mají podobu dlouhých řetězců (vznikají zřetězením menších jednotek, polymerací). Vyrábějí se nejčastěji z látek odvozených z ropy, existují ale i plasty vyráběné z biomasy. Plasty jsou zpravidla lehké a poměrně odolné, mají mnohdy jedinečné vlastnosti. Jejich výroba je levná. Nacházejí využití prakticky ve všech oborech lidské činnosti. Jejich masové využití s sebou nese ale i výrazné problémy pro životní prostředí či zdraví.
Příklady plastů
- polyethylen (PE) – Vzniká polymerací ethenu (ethylenu). Nejpoužívanější plast na světě. Rozlišuje se polyethylen s nízkou hustotou (LDPE – ♶) a vysokou hustotou (HDPE – ♴, tvrdší). LDPE se používá např. k výrobě sáčků a fólií, HDPE k výrobě obalů, nádob či trubek.
- polypropylen (PP) ♷ – Vzniká polymerací propenu (propylenu). Např. k výrobě obalů, vláken, dílů dopravních prostředků nebo lékařského vybavení.
- polyethylentereftalát (PET) ♳ – Zejména k výrobě PET lahví či oblečení.
- polystyren ♸ – Neměkčený např. k výrobě obalů, měkčený jako tepelná izolace budov či obalová výplň.
- polyvinylchlorid (PVC) ♵ – Vzniká polymerací chlorethenu (vinylchloridu). Např. k výrobě podlahových krytin či izolací kabelů.
- akrylonitrilbutadienstyren (ABS) – Velmi teplotně i mechanicky odolný.
- nylon – Označuje skupinu polyamidových vláken, v nichž jsou monomery spojené peptidovou vazbou. Např. k výrobě textilií nebo nádobí.
Plastový odpad, plasty a životní prostředí
Mnohé plasty je možné recyklovat (ovšem např. u PVC je recyklace neefektivní). Vytříděný plastový odpad se po svozu třídní dle jednotlivých typů plastů (ty jsou mj. označené recyklačními symboly, vizte výše). Plasty lze spalovat při vysokých teplotách, při nižších teplotách vznikají toxické produkty hoření. Další možností nakládání s plasty je dodnes skládkování.
Problémem je uvolňování plastů do životního prostředí, např. do moří a oceánů. Plasty se v přírodě rozkládají na drobné mikroplasty. Ty se dostávají do potravních řetězců a nashromažďují se ve tkáních živých organismů.
Plasty a zdraví
Mikroplasty se dostávají do potravy i kontaktem s obaly či nádobím. Jejich vliv na zdraví však dosud není zcela objasněn. Zdraví mohou ovlivňovat různé látky uvolňované z plastů (např. endokrinní disruptory ovlivňující hormonální systém, změkčovadla či těžké kovy). Čím vyšší teplota, tím více látek se z plastů uvolňuje (proto např. není dobré nechávat láhev s pitím v rozpáleném autě či vystavovat vysoké teplotě plastové nádobí, které pro to není určené).
NahoruChemie a výroba elektřiny
Při výrobě elektrické energie se používají buď vyloženě chemické děje (hoření), nebo děje fyzikální (ty bývají podmíněné využitím specifických chemických látek).
Hoření
Hoření je nejčastěji intenzivní reakce látek s kyslíkem, při níž se uvolňuje energie. Typicky se spalují fosilní paliva (uhlí, zemní plyn). Při spalování fosilních paliv v základu vzniká oxid uhličitý (\mathrm{CO_2}) a voda (\mathrm{H_2O}). Uhelné i paroplynové elektrárny patří mezi tepelné, které využívají roztáčení turbíny vodní parou (nebo produkty hoření).
Uhelné elektrárny v Česku spalují zejména hnědé uhlí těžené v severních Čechách, čímž se významně podílejí na emisích skleníkových plynů. Uhlí se před spalováním mele na prášek, aby hoření bylo efektivnější. Při spalování uhlí ve větší míře vznikají i složitější organické látky (např. benzopyren) a oxidy dusíku a síry. Ze spalin se odstraňuje popílek (obsahující hlavně anorganické netěkavé oxidy a soli) a oxid siřičitý (díky tomu vzniká energosádrovec využitelný ve stavebnictví).
Paroplynové elektrárny spalují zemní plyn (ten obsahuje hlavně methan – \mathrm{CH_4}). Využívají se zejména při zvýšené zátěži energetické sítě, lze je rychle nastartovat.
Spalovat lze i vodík (\mathrm{H_2}), při jeho reakci s kyslíkem vzniká pouze voda (\mathrm{H_2O}). Výroba vodíku rozkladem vody (elektrolýzou) je však značně energeticky náročná, spalovat ze účelem výroby elektřiny vodík vyrobený z fosilních paliv je neefektivní. Vodík a kyslík lze využívat v tzv. palivových článcích, které na elektrochemickém principu rovnou vytvářejí elektrickou energii.
Solární energie
Solární články (fotovoltaické články) přeměňují světlo na elektrickou energii. Využívají k tomu typicky polovodiče z křemíku (\mathrm{Si}). Kolem křemíkových krystalů bývá odrazivá vrstva z nitridu křemíku (\mathrm{SiN}_x), tyto součásti bývají chráněné sklem či polyvinylacetátem.
Jaderné elektrárny
Jaderné elektrárny využívají štěpnou reakci, nejčastěji uranu . Vzniklé teplo v primárním okruhu generátoru ohřívá vodu v sekundárním okruhu, pára pak roztáčí turbínu. Moderátory zpomalují neutrony, čímž podpoří jaderné přeměny (typicky voda, bor – např. ve formě kyseliny borité \mathrm{H_3BO_3}). Regulační tyče (např. z grafitu, karbidu boru – \mathrm{B_4C}) neutrony absorbují a tím jadernou reakci zpomalují.
Větrné elektrárny
Typicky se skládají z ocelového stožáru na železobetonové základně. Na vrcholu stožáru je rotor, který využívá k roztáčení kinetickou energii větru a tím generuje elektřinu. Samotné vrtule se pak skládají z odolného, avšak obtížně recyklovatelného kompozitního materiálu, který obsahuje typicky skleněná či uhlíková vlákna v pryskyřici/epoxidu.
Ukládání energie
Vzniklou elektrickou energii lze omezeně ukládat např. do akumulátorů (typicky využívajících lithium – \mathrm{Li}).
Nahoru
















