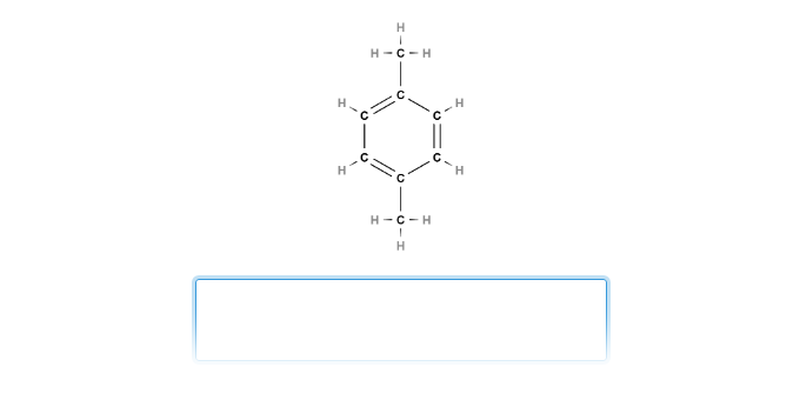
Aromatické uhlovodíky (areny) obsahují aspoň jedno aromatické jádro – delokalizovaný systém π elektronů. Zjednodušeně řečeno: elektrony, které by za normálních okolností tvořily část dvojné vazby na určitém místě, jsou rovnoměrně rozprostřeny v kruhu. To zajišťuje aromatickým uhlovodíkům mimořádnou stálost.
Znázornění aromatického jádra
Vzorce níže znázorňují jednu a tu samou molekulu, elektrony tvořící π vazby nejsou vázané na konkrétní místa.
Aromatické jádro se někdy zobrazuje jako šestiúhelník s kruhem uprostřed, to je ovšem nevýhodné při uvažování o posunu elektronů v rámci chemických reakcí.
Areny obvykle mají specifický zápach. Bývají velmi těkavé (to je někdy výhodné, když se používají jako rozpouštědla), zároveň bývají nebezpečné pro zdraví.
Příklady aromatických uhlovodíků
| Název | Vzorec | Informace |
|---|---|---|
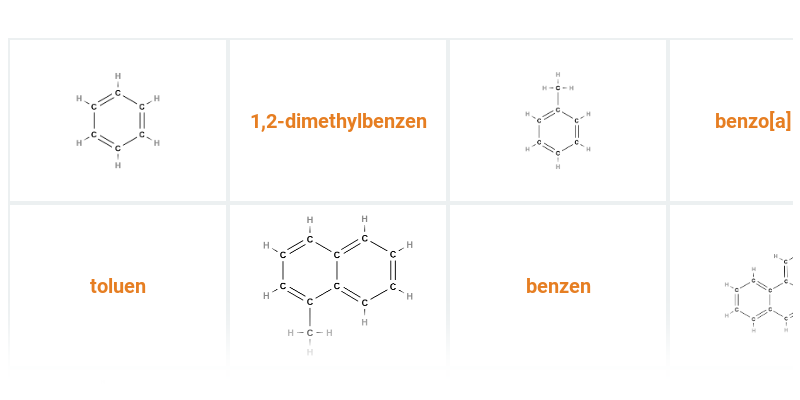
| benzen |  |
Bezbarvá kapalina, toxická, karcinogenní. Nepolární rozpouštědlo. |
| methylbenzen (triviálně toluen) |  |
Aromatické jádro s navázanou methylovou skupinou, poněkud méně toxický než benzen. Rozpouštědlo. Zneužíván jako inhalační droga. |
| ethenylbenzen (triviálně styren) |  |
Jeho polymerací vzniká plast polystyren. |
| naftalen |  |
Bílá krystalická pevná látka s typickým zápachem, dříve používán k hubení/odpuzování molů. |
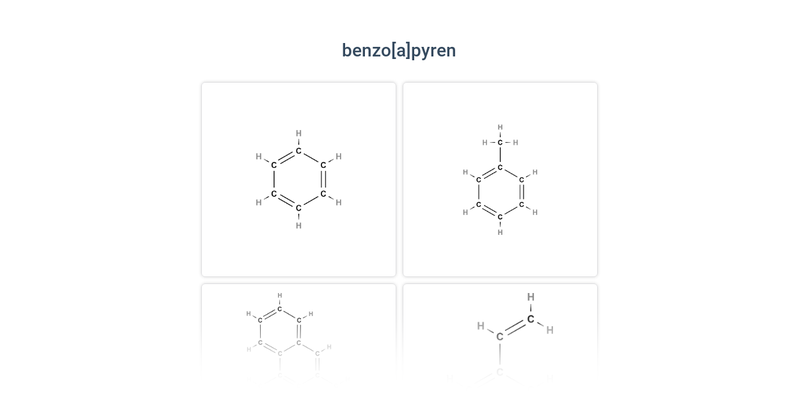
Při hoření organických látek mohou vznikat polycyklické aromatické uhlovodíky (např. benzo[a]pyren sestávající z pěti aromatických jader). Tyto látky jsou značně nebezpečné pro zdraví, nacházejí se např. v cigaretovém kouři, spalinách z dopravních prostředků (jsou součástí smogu) či v grilovaných/připálených potravinách.
Reakce aromatických uhlovodíků
Typickou reakcí aromatických uhlovodíků je elektrofilní substituce (dochází k náhradě H na aromatickém jádře).
Rozhodovačka
Rychlé procvičování výběrem ze dvou možností.
Otázky
Výběr správné odpovědi z nabízených možností.
Poznávačka
Procvičování pojmů nebo názvů. Obsahuje dynamickou nápovědu.