Výpis souhrnů
Obecná chemie
Prohlížíte si souhrny informací k určitým tématům. Systémy Umíme se zaměřují hlavně na jejich procvičování. Ke cvičením k jednotlivým podtématům se dostanete pomocí odkazů níže.
Podtémata
- Vlastnosti látek, skupenství
- Směsi
- Atom, prvky
- Radioaktivita
- Elektronová konfigurace, kvantová čísla
- Chemická vazba, molekuly
- Chemická vazba: pokročilejší souvislosti
- Ionty
- Prvky, molekuly a počet částic
- Úvod do chemických reakcí
- Vyčíslování chemických rovnic
- Redoxní reakce
- Elektrochemie
- Kyselost a zásaditost roztoků, pH
- Látkové množství, molární hmotnost
- Výpočty z chemických rovnic
- Látková koncentrace
- Hmotnostní zlomek
- Výpočty z chemických vzorců
- Skupiny chemických látek
Vlastnosti látek, skupenství
Chemická látka je forma hmoty. Má určité složení a strukturu, sestává z částic (molekul, atomů/iontů). Látkami jsou tvořena tělesa.
Skupenství látek
- Látky v pevném skupenství mají těsně uspořádané částice, ty se výrazněji nepohybují. Pevná tělesa mají stálý tvar a objem.
- Látky v kapalném skupenství mají částice jsou blízko sebe, ale mohou se volně pohybovat. Kapalná tělesa mají stálý objem, tvar mění podle nádoby.
- Látky v plynném skupenství mají částice daleko od sebe, tyto částice na sebe víceméně nepůsobí.
Kapaliny a plyny se souhrnně označují jako tekutiny.
Skupenské přeměny
Skupenství látek je závislé na teplotě a tlaku. Změna těchto podmínek vede ke změnám skupenství:
Jako var se označuje jev, kdy se kapalina vypařuje v celém svém objemu. Více skupenství určité látky může existovat současně: např. vodní pára se ve vzduchu nachází, aniž by bylo dosaženo teploty varu.
Vlastnosti látek a jejich zkoumání
Mezi fyzikální vlastnosti látek patří např. skupenství, barva, elektrická vodivost, tvrdost či hustota. Mezi chemické vlastnosti náleží např. reaktivita, hořlavost, pH (kyselost/zásaditost) či rozpustnost. Vlastnosti látek lze zkoumat např. měřením, pozorováním či pokusem.
NahoruSměs se skládá z více chemických látek (respektive více chemicky čistých látek). Při jejich mísení nedochází ke změnám vazeb. Mohou se však měnit fyzikální vlastnosti: např. voda se solí má nižší teplotu tání než čistá voda.
Stejnorodé směsi
Stejnorodé (homogenní) směsi se také označují jako roztoky. Jejich součásti nelze odlišit okem ani mikroskopem. Mohou být pevné (např. slitiny kovů), kapalné (např. sůl rozpuštěná ve vodě) či plynné (složky vzduchu, propan-butan).
Různorodé směsi
Různorodé (heterogenní) směsi sestávají ze složek, které lze vzájemně odlišit.
| Typ různorodé směsi | Obsažené látky (fáze) | Konkrétní příklad |
|---|---|---|
| suspenze | pevná látka v kapalině | písek rozptýlený ve vodě |
| emulze | kapalina rozptýlená v jiné kapalině, tyto kapaliny jsou vzájemně nemísitelné | olej ve vodě, majonéza |
| pěna | plyn v kapalině | pěnící šampon |
| aerosol | kapalina/pevná látka v plynu | mlha, dým, kouř |
Koloidní směsi
Koloidní směsi mají částice velké \mathrm{10^{-7}–10^{-9}\;m}, tedy na pomezí stejnorodých a různorodých směsí.
Oddělování složek směsí
Mezi metody oddělování složek směsí patří například:
- sedimentace (usazování) – Obvykle oddělování pevné a kapalné látky, založena na rozdílných hustotách.
- krystalizace – Oddělení rozpuštěné pevné pátky z roztoku, např. krystalizace mořské soli.
- filtrace – Zachycování pevné látky na filtru (např. síto, písek, tkanina, filtrační papír aj.).
- chromatografie – Metoda, při níž složky mobilní fáze různou rychlostí putují stacionární fází (často chromatografickou kolonou), používá se v analytické chemii.
- destilace – Oddělování kapalných složek směsi na základě jejich rozdílných teplot varu, např. destilace při výrobě alkoholických nápojů či frakční destilace ropy.
Atom, prvky
Atom je základní stavební částice hmoty.
Stavba atomu
Atomové jádro obsahuje kladně nabité protony (\mathrm{p^+}) a elektricky neutrální neutrony (\mathrm{n^0}). Protony a neutrony se souhrnně označují jako nukleony. Vně jádra se nachází elektronový obal, který obsahuje záporně nabité elektrony (\mathrm{e^-}). Ty se zde nacházejí ve „vrstvách“. Elektrony náležící do energeticky nejvýše položené vrstvy se označují jako valenční, ty zodpovídají za většinu chemických vlastností látky, kterou tvoří.
Počet protonů a počet elektronů v atomu je v základu stejný, atom jako celek je tedy elektricky neutrální.
Zobrazení atomu jsou pouze modely
Jednotlivé atomy jsou menší než vlnová délka viditelného světla, nelze je tedy přímo pozorovat/zobrazit. Vyobrazení atomů v učebních materiálech jsou jen modely, které přibližují rozložení částí atomu. Zhruba odpovídají Bohrově modelu atomu, který byl aktuální zhruba před 100 lety.
Co se týče těchto modelů, mnohdy také vyvolávají zkreslenou představu o velikostech. Např. jádro atomu uhlíku (\mathrm{C}) je asi 26 000× menší než celý atom. Uvažujme, že Moravské náměstí v Brně má zhruba velikost kruhu o průměru 150 m. \frac{1}{26\,000} by odpovídala asi 6 cm (o něco méně než je průměr tenisového míčku). Většina atomu je tedy „prázdný prostor“ (v rámci obalu se v něm s určitou pravděpodobností mohou vyskytovat elektrony).
Chemické prvky
Chemický prvek je látka složená z atomů, které mají ve svých jádrech určitý počet protonů. Prvky se popisují značkami (např. \mathrm{O} = kyslík, \mathrm{Co} = kobalt). Značky se píší vždy s velkým počátečním písmenem (další písmena jsou malá), hláskují se (např. \mathrm{Al} = [á el]). Názvy prvků v češtině začínají malým písmenem (např. hliník).
Počet protonů v jádře atomu popisuje protonové číslo (značí se Z, zapisuje se jako dolní index před značku prvku. Tedy například: \mathrm{_{8}O} – atomy s protonovým číslem 8 tvoří prvek kyslík (\mathrm{O}), \mathrm{_{15}P} – atomy s protonovým číslem 15 tvoří prvek fosfor (\mathrm{P}).
Nukleonové číslo (A) značí počet částic v jádře atomu, píše se jako horní index před značku prvku. Neutronové číslo (N) se obvykle neuvádí, spočítá se jako rozdíl nukleonového a protonového čísla: N = A - Z.
Příklad: protonové, nukleonové a neutronové číslo
\mathrm{^{238}_{\phantom{0}92}{U}} – Tato konkrétní forma prvku uranu má ve svých atomech 238 částic v jádře, z toho 92 částic jsou protony. Počet neutronů (neutronové číslo) se tedy spočítá jako rozdíl nukleonového a protonového čísla: 238 - 92 = 146.
Izotopy
Izotopy jsou varianty chemického prvku, které mají stejné protonové číslo (tedy obsazují stejné místo periodické tabulky), ale liší se neutronovým číslem. Izotopy se mezi sebou mohou lišit tím, zda jsou stabilní či podléhají radioaktivní přeměně. Příkladem mohou být izotopy vodíku:
| Značka | Název izotopu | Protonů | Neutronů | Stabilní |
|---|---|---|---|---|
| \mathrm{^{1}_{1}H} | protium | 1 | 0 | ano |
| \mathrm{^{2}_{1}H} | deuterium | 1 | 1 | ano |
| \mathrm{^{3}_{1}H} | tritium | 1 | 2 | ne, poločas rozpadu 12,32 let |
Množina atomů s odpovídajícím protonovým a nukleonovým číslem se označuje jako nuklid.
Periodická tabulka prvků
Prvky jsou na základě svých protonových čísel a opakujících se vlastností uspořádány v periodické tabulce (soustavě).
NahoruRadioaktivita
Radioaktivita je jev, při němž dochází k přeměně jader atomů (např. i na jádra jiných prvků). Zároveň může vznikat vysokoenergetické ionizující záření. Poločas přeměny (T_{\frac{1}{2}}) je doba, během níž dojde k přeměně poloviny jader ve vzorku.
Radionuklidy
Radioaktivní nuklidy (radionuklidy) se přirozeně vyskytují v přírodě. Přirozenou radioaktivitu popsal Henri Becquerel u solí uranu, radioaktivitou se dále zabývala Marie Curie-Skłodowská, která mj. popsala prvky radium a polonium. Radionuklidy lze též uměle připravovat působením jiných částic či záření na atomy.
Typy záření
- záření α – Jedná se o rychle se pohybující jádra helia \mathrm{^{4}_{2}He}. Při jejich vyzáření vzniká nuklid, který má o 4 nukleony a 2 protony méně než původní atom: ^A_Z{X} \longrightarrow {^{A-4}_{Z-2}{Y}} + \mathrm{^4_2{He}}.
- záření β – Jde o proud elektronů (přeměna β⁻) či pozitronů (přeměna β⁺). Vznik β⁻ záření popisuje rovnice ^A_Z{X} \longrightarrow {^{\phantom{Z+\!}A}_{Z+1}{Y}} + \mathrm{^{\phantom{1}0}_{–1}{e}} (vzniká nuklid s protonovým číslem vyšším o 1).
- záření γ – Je elektromagnetické vlnění s vysokou energií, je značně pronikavé.
Vliv ionizujícího záření, jednotky
Ionizující záření ničí/mění biomolekuly, čímž mj. způsobuje mutace. Vystavení tomuto záření tedy buď přímo poškozuje tkáně, nebo např. zvyšuje riziko vzniku zhoubných nádorů. Zvýšená expozice tomuto záření nastává při cestách do vesmíru (mimo magnetické pole Země). Absorbovaná dávka záření se vyjadřuje v jednotce gray (Gy), ekvivalentní dávka záření (bere v potaz různé působení záření na tkáně) má jednotku sievert (Sv).
Využití ionizujícího záření
Ionizující záření se využívá v lékařství (radioterapie), neboť nádorové buňky jsou k němu obvykle citlivé. Další využití v lékařství má radioaktivita v rámci zobrazovacích metod (např. pozitronová emisní tomografie = PET).
Zkoumání přítomnosti určitých nuklidů prvků se využívá při datování hornin či paleontologických či archeologických nálezů. Neřízené řetězové jaderné reakce jsou principem fungování jaderných zbraní.
Štěpné jaderné reakce zahrnují rozpad těžšího jádra na jádra lehčí, využívají se např. v jaderných elektrárnách. Při termonukleární fúzi dochází ke spojování lehkých jader za vzniku jader těžších, tento děj probíhá zejména v nitru hvězd. V plánu je dosáhnout řízené termojaderné fúze na Zemi a využívat ji jako energetický zdroj.
NahoruElektronová konfigurace, kvantová čísla
Chemické vlastnosti určitého prvku jsou ovlivněny zejména stavbou elektronového obalu jeho atomů.
Elektrony, orbitaly
Elektrony mají dle kvantově mechanického modelu charakter vlny i částice (to se označuje jako dualismus). Nelze např. současně určit jejich polohu a hybnost, lze určit jen pravděpodobnost, s níž se budou vyskytovat v určitém prostoru. Oblast s určitou pravděpodobností výskytu elektronu (obvykle >95 %) se nazývá orbital.
Kvantová čísla
Stav elektronu lze popsat pomocí kvantových čísel:
- Hlavní kvantové číslo (n) je přirozené číslo. Souvisí s energií elektronů a velikostí orbitalů (čím větší n, tím se elektrony mohou nacházet dále od jádra).
- Vedlejší kvantové číslo (l) udává typ orbitalu, spočítá se dle vztahu l = n - 1. Podle vedlejšího kvantového čísla se orbitaly označují písmeny: 0 = s, 1 = p, 2 = d, 3 = f.
Tvary orbitalů, souvislosti

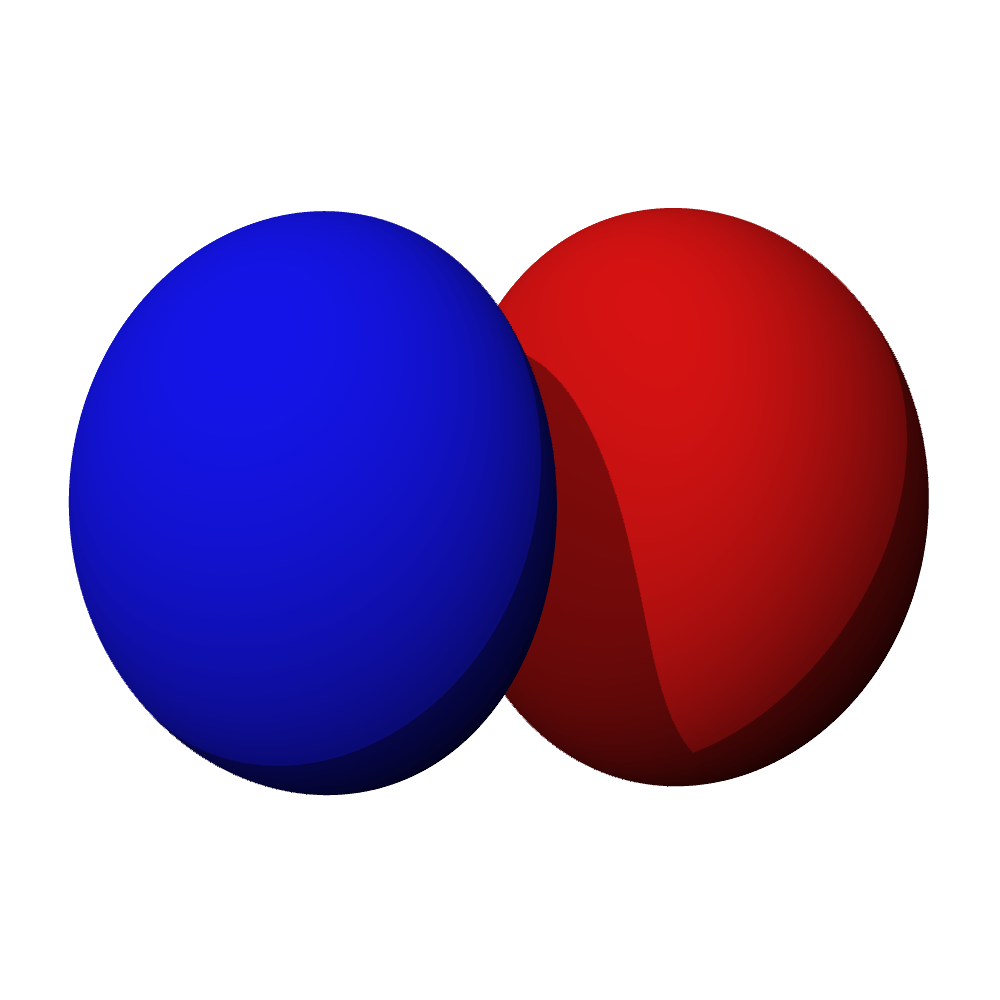
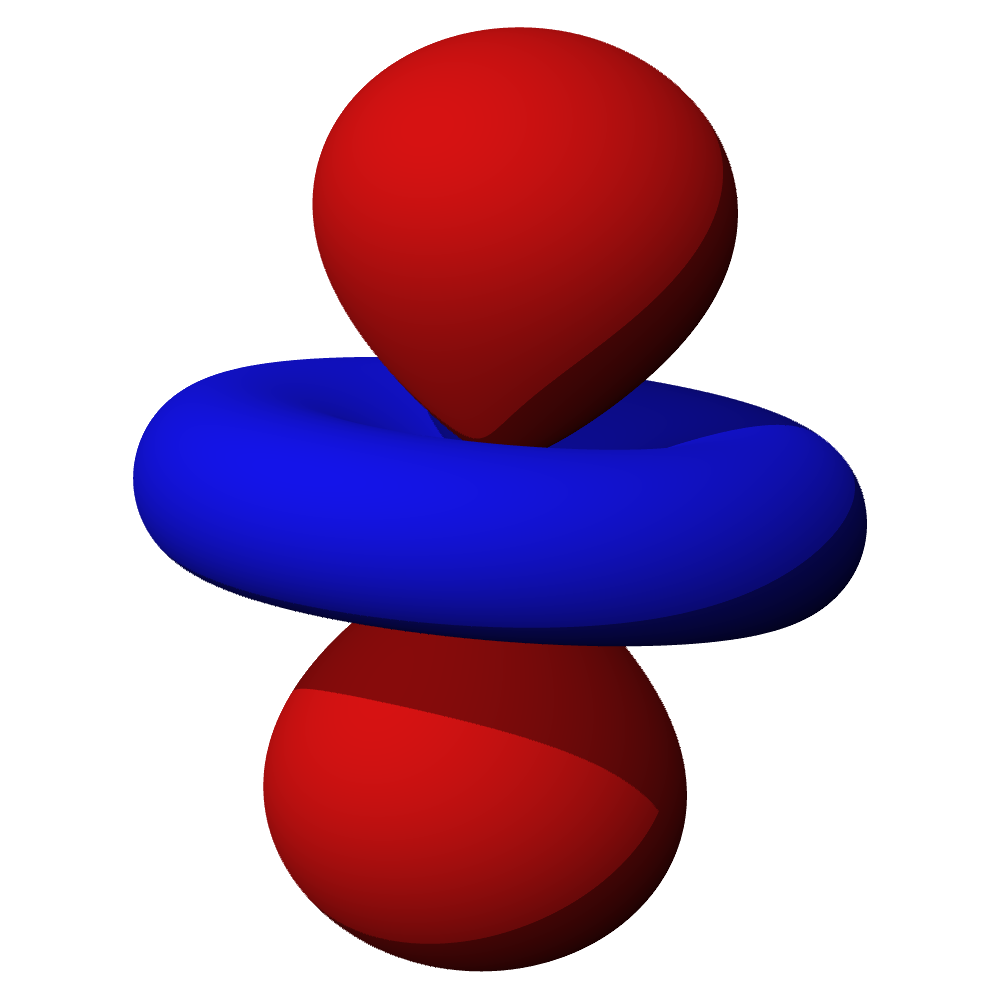
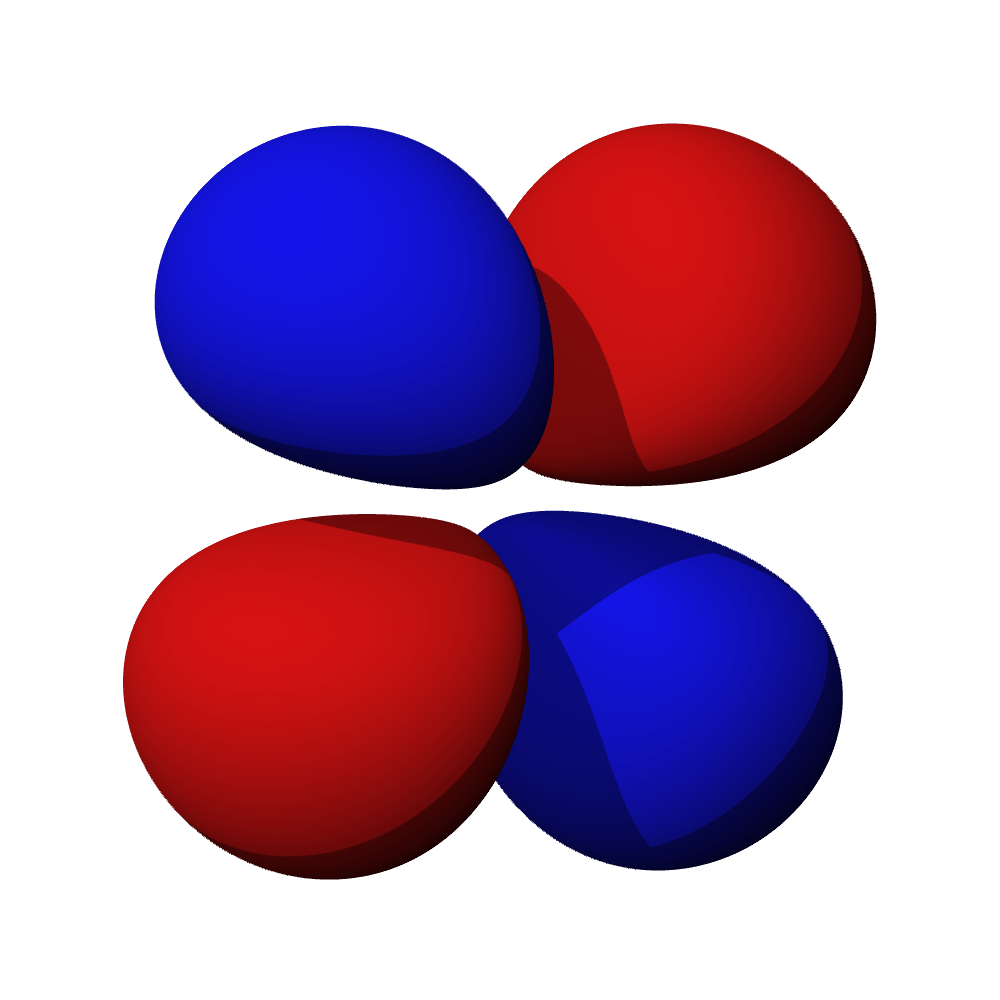
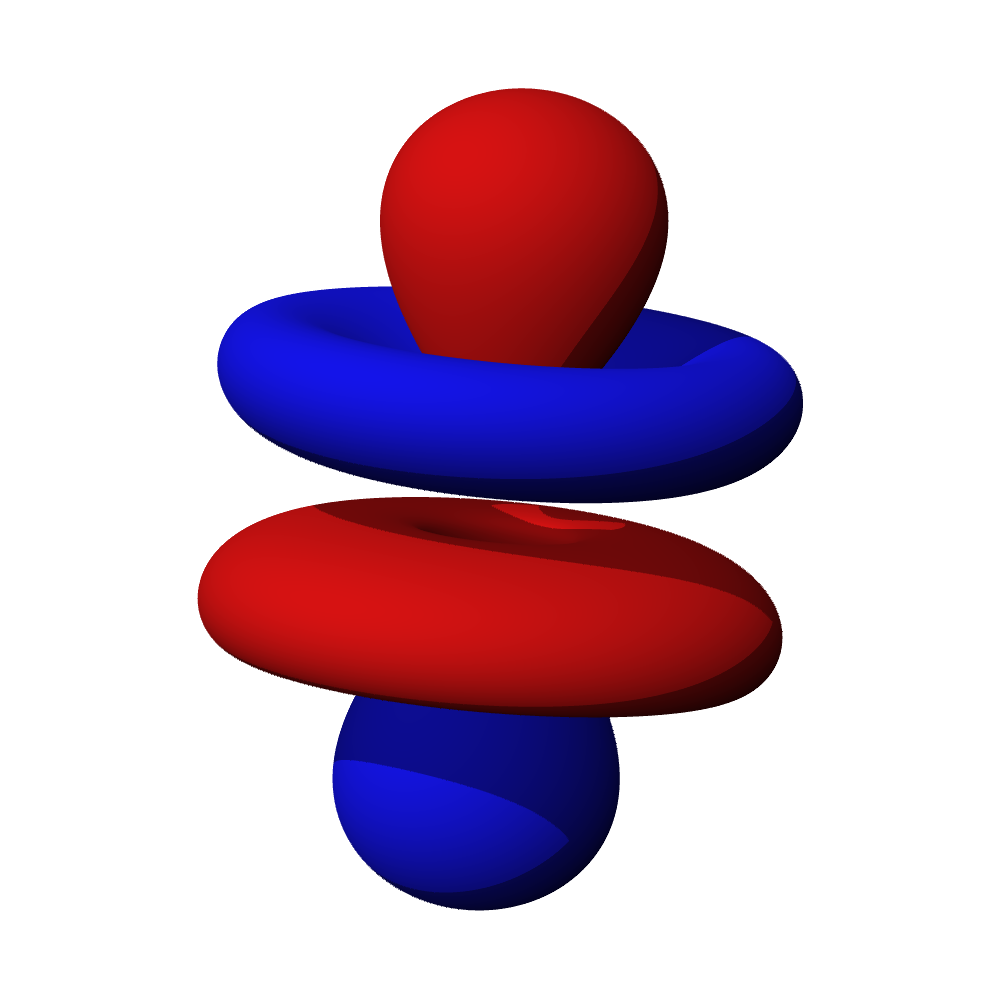
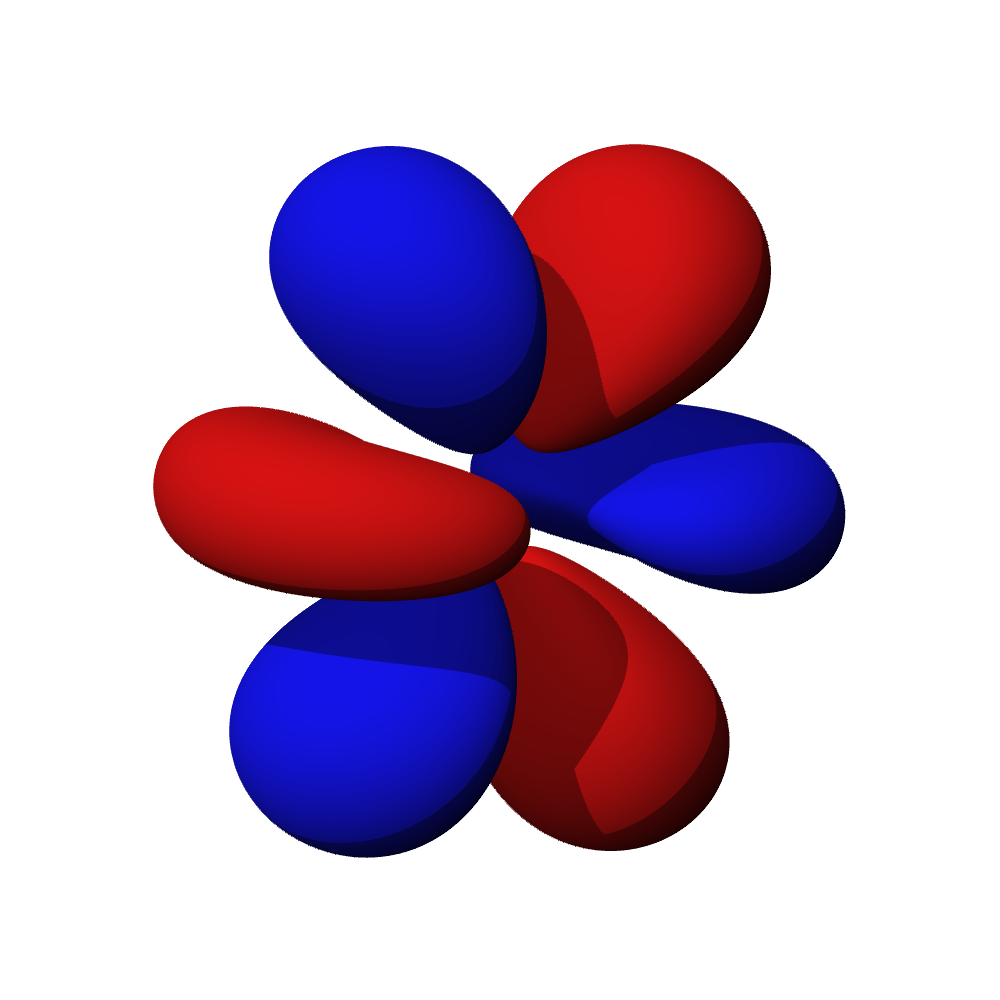
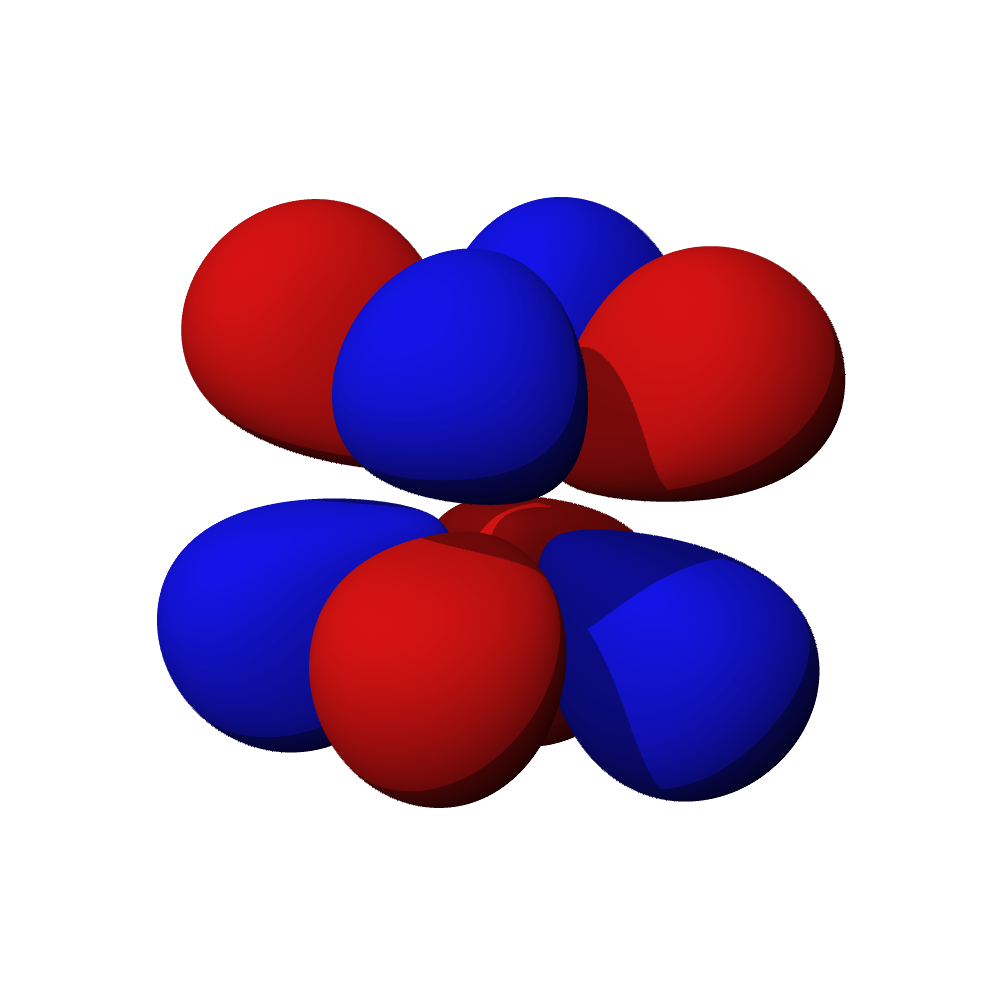
- Orbitaly s mají tvar koule. Orbitaly p se podobají dvěma lalokům. Tvary orbitalů d a f jsou komplexnější.
- Orbital d obsazují přechodné kovy, orbital f vnitřně přechodné kovy (lanthanoidy, aktinoidy). Prvky obsazující orbital g zatím nebyly objeveny.
- Magnetické kvantové číslo (m) udává prostorovou orientaci orbitalu, nabývá celočíselných hodnot od -l do l (včetně 0). Počet magnetických kvantových čísel pro určité vedlejší kvantové číslo souvisí s počtem případných degenerovaných orbitalů (orbitaly, které mají při stejné energii různou prostorovou orientaci).
Příklad: magnetické kvantové číslo
Pokud je vedlejší kvantové číslo l = 1 (typ orbitalu p) jsou magnetická kvantová čísla m = -1; 0; 1: \boxed{\phantom{\uparrow \downarrow} }\,\boxed{\phantom{\uparrow \downarrow} }\,\boxed{\phantom{\uparrow \downarrow} }. Typ orbitalu p se tedy rozděluje na tři degenerované orbitaly s různou prostorovou orientací.
- Spinové kvantové číslo (s) charakterizuje spin elektronu, nabývá hodnoty \frac{1}{2} či - \frac{1}{2}. V grafickém znázornění šipka značí elektron, spin se vyjadřuje směrem šipky (např. \boxed{\uparrow \downarrow }).
Valenční elektrony
Za chemické vlastnosti atomů zodpovídají zejména valenční elektrony, ty se nacházejí v orbitalech s nejvyšším hlavním kvantovým číslem (u přechodných kovů i s druhým nejvyšším). Mohou tedy být nejdále od jádra a mají nejvyšší energii.
Částice nepřechodných prvků jsou obvykle stabilní, když jejich valenční vrstva odpovídá valenční vrstvě vzácného plynu (neboli obsahuje nejčastěji 8 elektronů = oktet). To je důvodem, proč některé prvky ochotně tvoří ionty (např. \mathrm{O^{2-}}, \mathrm{F^{-}}, \mathrm{Na^{+}}, \mathrm{Mg^{2+}} mají 8 valenčních elektronů jako neon).
Elektronová konfigurace
Elektronová konfigurace popisuje uspořádání elektronů v orbitalech. U zkráceného textového zápisu se zahrnuje předchozí vzácný plyn, explicitně jsou tedy vypsány jen valenční elektrony:
| Prvek | Schematický zápis (šipka = elektron) | Textový zápis | Zkrácený textový zápis |
|---|---|---|---|
| lithium (\mathrm{Li}) | \mathrm{1s}\,\boxed{\uparrow\downarrow}\;\mathrm{2s}\,\boxed{\uparrow\ } | \mathrm{1s^2}\,\mathrm{2s^1} | \mathrm{[He]}\,\mathrm{2s^1} |
| hořčík (\mathrm{Mg}) | \mathrm{1s}\,\boxed{\uparrow\downarrow}\;\mathrm{2s}\,\boxed{\uparrow\downarrow}\;\mathrm{2p}\,\boxed{\uparrow \downarrow}\,\boxed{\uparrow \downarrow}\,\boxed{\uparrow \downarrow}\;\mathrm{3s}\,\boxed{\uparrow \downarrow } | \mathrm{1s^2}\,\mathrm{2s^2}\,\mathrm{2p^6}\,\mathrm{3s^2} | \mathrm{[Ne]}\,\mathrm{3s^2} |
V rámci elektronové konfigurace platí:
- Pauliho princip výlučnosti – V atomu není více elektronů, které by měly všechna kvantová čísla stejná. V jednom orbitalu mohou být nanejvýš dva elektrony lišící se spinovým číslem (např. \boxed{\uparrow \downarrow }).
- Hundovo pravidlo – Degenerované orbitaly (orbitaly se stejnou energií) se nejprve zaplňují vždy nejprve jedním elektronem, pak až dvěma. Příklad na orbitalu p se 3 elektrony: \boxed{\uparrow\ }\,\boxed{\uparrow\ }\,\boxed{\uparrow\ }, se 4 elektrony: \boxed{\uparrow\downarrow}\,\boxed{\uparrow\ }\,\boxed{\uparrow\ }.
- výstavbový princip – Orbitaly s nižší energií se zaplňují dříve než orbitaly s vyšší energií (1s, 2s, 2p, 3s, 3p, 4s…).
Excitovaný stav
Při excitaci atomu elektron či elektrony přijmou energii a dostávají se do orbitalu s vyšší energií (poruší výstavbový princip). Níže je příklad elektronové konfigurace atomu \mathrm{C} a excitovaného atomu \mathrm{C}. \mathrm{C\!: 1s\,\boxed{\uparrow\downarrow}\;2s\,\boxed{\uparrow\downarrow}\;2p\,\boxed{\uparrow\ }\,\boxed{\uparrow\ }\,\boxed{\phantom{\uparrow}\ }}
\mathrm{C^*\!: 1s\,\boxed{\uparrow\downarrow}\;2s\,\boxed{\uparrow\ }\;2p\,\boxed{\uparrow\ }\,\boxed{\uparrow\ }\,\boxed{\uparrow\ }}
NahoruChemická vazba, molekuly
Částice mohou být stabilnější, pokud se sloučí s jinými částicemi, neboli mezi sebou vytvoří chemickou vazbu. Vazeb se účastní valenční elektrony, nové vazby se tvoří při chemických reakcích. Díky chemickým vazbám mohou vznikat molekuly (částice z více atomů/iontů), ale také sloučeniny (ty obsahují více různých prvků).
V rámci jednoduché kovalentní vazby jsou atomy spojené díky elektronovému páru. Kovalentních vazeb mezi atomy může být i více, na dvojné vazbě se podílí 2 elektronové páry (4 elektrony), na trojné se podílí 3 elektronové páry (6 elektronů). Díky kovalentní vazbě atomy mnohdy dosahují elektronové konfigurace nejbližšího vzácného plynu.
Elektronegativita je schopnost atomu přitahovat (vazebné) elektrony. Její hodnotu lze najít v periodické tabulce. Dle polarity – rozdílu elektronegativit (\Delta\chi) zúčastněných atomů – se rozlišuje:
- nepolární vazba – Vazebné elektrony jsou rozloženy téměř rovnoměrně (\Delta\chi \lt 0{,}4).
- polární vazba – Vazebné elektrony jsou posunuty k atomu s vyšší elektronegativitou (\Delta\chi = 0{,}4{-}1{,}7).
- iontová vazba – Tvoří se ionty (\Delta\chi \gt 1{,}7).
Hranice mezi výše uvedenými typy vazeb jsou neostré. Obvykle platí, že polární (iontové) látky se rozpouštějí v polárních rozpouštědlech, nepolární v nepolárních.
NahoruChemická vazba: pokročilejší souvislosti
Základním a častým typem vazby je kovalentní vazba. Kovalentní vazba může být:
- jednoduchá – Vazba σ (sigma), u té je elektronová hustota je nejvyšší na spojnicích jader atomů účastnících se vazby. Dochází ke sdílení jednoho elektronového páru.
- dvojná – Tvořena vazbou σ a vazbou π (pí, u vazby π se překrývají orbitaly mimo spojnici jader). Dochází ke sdílení dvou elektronových párů.
- trojná – Sestává z jedné vazby σ a dvou vazeb π. Sdílejí se tři elektronové páry.
Kromě kovalentní vazby existují další typy vazeb.
Koordinačně kovalentní vazba
V rámci této vazby je jeden atom dárce (donor) elektronového páru a druhý je příjemce (akceptor). Uplatňuje se např. při vzniku amonného kationtu (\mathrm{NH_4^+}, \mathrm{N} poskytuje elektronový pár) nebo u komplexních sloučenin.
Kovová vazba
Vzniká v kovech v tuhém stavu, kde valenční elektrony vytvářejí tzv. elektronový plyn a volně se pohybují mezi kationty kovů. Tato vazba podmiňuje vlastnosti kovů: elektrickou a tepelnou vodivost, kujnost a tažnost.
Slabé vazebné interakce
Vodíkové můstky vznikají mezi atomem vodíku a atomem s vysokou elektronegativitou (\mathrm{F}, \mathrm{O}, \mathrm{N}), který obsahuje aspoň jeden volný elektronový pár. Zvyšují teplotu varu látek (např. vody), jsou zásadní třeba pro stavbu dvoušroubovice DNA.
Van der Waalsovy síly jsou slabší než vodíkové můstky, díky nim se na určitou vzdálenost přitahují/odpuzují všechny typy částic.
NahoruIonty jsou elektricky nabité částice, které vznikají z atomů (či molekul) přijetím či odevzdáním elektronů.
- Kationty jsou kladně nabité, počet elektronů v nich je nižší než počet protonů.
- Anionty jsou záporně nabité, počet elektronů v nich je vyšší než počet protonů.
Kation(t), anion(t)
V 1. pádu jednotného čísla se názvy iontů obvykle píší bez „t“ na konci (kation, anion), varianta s „t“ na konci je méně častá, ale také správně (kationt, aniont). Při skloňování či v množném čísle se ovšem „t“ ve slovech vyskytuje (kationtu, kationty).
Náboj iontů se vyznačuje arabskou číslicí a znaménkem (nebo jen znaménkem) v horním indexu za značkou prvku. Např. \mathrm{Al^{3+}} = kation hlinitý. Oproti elektricky neutrálnímu atomu hliníku (13 elektronů) má o 3 elektrony méně (10 elektronů).
Při pojmenovávání kationtů se používají koncovky, které vyjadřují jejich náboj:
| Náboj iontu | Koncovka | Příklad |
|---|---|---|
| \mathrm{+} | -ný | \mathrm{Na^+} = kation sodný |
| \mathrm{2+} | -natý | \mathrm{Mg^{2+}} = kation hořečnatý |
| \mathrm{3+} | -itý | \mathrm{Fe^{3+}} = kation železitý |
Náboj × oxidační číslo iontů
- Oxidační číslo je myšlený (formální) náboj částice.
- U iontů vzniklých z jednotlivých atomů oxidační číslo obvykle odpovídá jejich reálnému náboji. V zásadě je tedy možné např. zaměňovat zápis \mathrm{Mg^{2+}} a \mathrm{Mg^{II}}.
- Pro hodnotu kladných oxidačních čísel a nábojů se také používají stejné názvoslovné koncovky.
Názvy jednoatomových aniontů končí na -idový, např. \mathrm{Cl^-} = anion chloridový. Anionty odvozené od kyslíkatých kyselin mají koncovku -anový, např. \mathrm{{SO_3}^{2-}} = anion siřičitanový.
NahoruPrvky, molekuly a počet částic
Prvky
Chemické prvky se popisují určitou značkou, která sestává z jednoho či dvou písmen. První písmeno je vždy velké. Např. \mathrm{N} = dusík, \mathrm{Fe} = železo.
Molekuly
Více atomů může tvořit molekuly, jejich složení se vyjadřuje chemickým vzorcem. Pokud se v molekule nachází více atomů určitého prvku, tento počet se vyjádří arabskou číslicí za značkou prvku v dolním indexu. Např. \mathrm{N_2} = dvouatomová molekula dusíku.
Sloučeniny
Molekuly sloučenin se skládají z více různých prvků. Např. sloučenina oxid dusitý má vzorec \mathrm{N_2O_3}, každá jeho molekula se skládá ze dvou atomů dusíku (\mathrm{N}) a tří atomů kyslíku (\mathrm{O}). Počet částic v dolním indexu se vždy týká jen nejbližší předcházející značky prvku, tedy např. číslo 3 u značky kyslíku (\mathrm{O}) nesouvisí s počtem atomů dusíku (\mathrm{N}).
Pokud se některá částice v molekule nachází pouze jednou, např. uhlík (\mathrm{C}) v oxidu uhličitém (\mathrm{CO_2}), číslice 1 se nepíše.
V chemických vzorcích je možné pomocí závorek vyjadřovat i větší počet skupin atomů. Např. molekula dusičnanu vápenatého – \mathrm{Ca(NO_3)_2} – sestává z 1 atomu vápníku (\mathrm{Ca}), 2 atomů dusíku (\mathrm{N}) a 6 atomů kyslíku (\mathrm{O}). Číslem za závorkou tedy „roznásobujeme“ počet částic každého prvku v závorce.
Příklady
| Vzorec | Počty jednotlivých atomů v molekule | Celkem atomů | Celkem různých prvků |
|---|---|---|---|
| \mathrm{(NH_4)_3PO_4} | 3 atomy \mathrm{N} 12 atomů \mathrm{H} 1 atom \mathrm{P} 4 atomy \mathrm{O} |
20 | 4 |
| \mathrm{Al(OH)_3} | 1 atom \mathrm{Al} 3 atomy \mathrm{O} 3 atomy \mathrm{H} |
7 | 3 |
| \mathrm{H_2SO_3} | 2 atomy \mathrm{H} 1 atom \mathrm{S} 3 atomy \mathrm{O} |
6 | 3 |
Úvod do chemických reakcí
Chemická reakce je děj, při němž dochází ke změnám chemických vazeb. Látky vstupující do reakce (výchozí látky, edukty) se mění na produkty. Všechny látky účastnící se chemické reakce se nazývají reaktanty.
Chemické rovnice
Průběh chemické reakce se zapisuje chemickou rovnicí. Jednotlivé zúčastněné látky se oddělují znaménkem „+“, mezi výchozí látky a produkty reakce se zapisuje šipka (⟶).
\mathrm{C + O_2 \longrightarrow CO_2}
Rovnice výše lze přečíst takto: uhlík reaguje s dvouatomovou molekulou kyslíku (kyslíkem), vzniká oxid uhličitý.
Počet částic jednotlivých prvků ve výchozích látkách a produktech je stejný, platí zákon zachování hmotnosti. To se vyjadřuje vyčíslením rovnice, uváděním tzv. stechiometrických koeficientů (píší se jako přirozená čísla před vzorce či značky prvků, 1 se neuvádí).
\mathrm{2\,C + O_2 \longrightarrow 2\,CO}
Rovnice výše je vyrovnaná tak, aby se ve výchozích látkách i produktech nacházely dva atomy C a dva atomy O: Dva mol („díly“) uhlíku reagují s kyslíkem, vznikají dva mol oxidu uhelnatého.
Reakce podle přijatého/vydaného tepla
Podle přijatého/vydaného tepla se reakce dělí na exotermické (teplo se uvolňuje) a endotermické (teplo se spotřebovává).
Ovlivňování rychlosti reakcí
Rychlost reakce ovlivňují následující faktory (čím větší míra faktoru, tím zpravidla rychlejší reakce):
- koncentrace výchozích látek
- teplota
- velikost povrchu reaktantů
- přítomnost katalyzátorů
Katalyzátory jsou látky, které urychlují chemické reakce. Snižují aktivační energii a tvořením meziproduktů „vedou“ reakci jinou cestou. Vystupují z reakce v původní podobě. Katalyzátory se typicky využívají ve spojení se spalovacími motory, snižují množství vypouštěných jedovatých látek. V živých organismech jako katalyzátory fungují enzymy.
NahoruVyčíslování chemických rovnic
Při chemických reakcích z výchozích látek vznikají produkty. Chemické reakce se popisují chemickými rovnicemi.
Zákon zachování hmotnosti
V rámci chemických reakcí dochází ke změnám chemických vazeb mezi částicemi (atomy/ionty). Částice samotné se ale nemění, jen se jinak přeskupí a navzájem navážou. Platí tedy zákon zachování hmotnosti: počet a typ částic v rámci výchozích látek odpovídá počtu a typu částic v produktech. Stejně tak hmotnost výchozích látek odpovídá hmotnosti produktů.
Vyčíslování rovnic
Mějme rovnici: \mathrm{Fe + O_2 \longrightarrow Fe_2O_3}
| Počet částic ve výchozích látkách | Počet částic v produktech |
|---|---|
| 1 atom železa (\mathrm{Fe}) 2 atomy kyslíku (\mathrm{O}) |
2 atomy železa (\mathrm{Fe}) 3 atomy kyslíku (\mathrm{O}) |
Zákon zachování hmotnosti výše není dodržen, rovnici je potřeba vyrovnat (vyčíslit) tak, aby si počty částic ve výchozích látkách a produktech odpovídaly. To se provede přidáním tzv. stechiometrických koeficientů. Stechiometrické koeficienty jsou čísla, která se píší před vzorce určitých látek v reakci. Popisují, v jakém poměru spolu určité látky reagují (co se týče látkového množství, nebo zkrátka počtu molekul/atomů). Je-li koeficient 1, obvykle se nepíše.
Vyrovnaná rovnice bude vypadat takto: \mathrm{4\;Fe + 3\;O_2 \longrightarrow 2\;Fe_2O_3}
| Počet částic ve výchozích látkách | Počet částic v produktech |
|---|---|
| 4 atomy železa (\mathrm{Fe}) 6 atomů kyslíku (\mathrm{O}) |
4 atomy železa (\mathrm{Fe}) 6 atomů kyslíku (\mathrm{O}) |
Rovnici je pak možné přečíst takto: 4 mol („díly“) železa reagují se 3 mol dvouatomových molekul kyslíku, vznikají 2 mol oxidu železitého.
Při vyrovnávání rovnic nezasahujeme do vzorců
Při vyrovnávání rovnic nelze upravovat samotné vzorců látek. Mohlo by tak dojít ke změně na vzorec zcela jiné (či nereálné) látky. Např. ze vzorce oxidu železitého výše nelze udělat vzorec neexistujícího „oxidu železičitého“ ().
Jak vyčíslovat rovnice
Při vyčíslování neredoxních rovnic je nutné postupně vyrovnávat množství jednotlivých prvků, případně si sestavit soustavu matematických rovnic.
Při vyčíslování redoxních rovnic lze vycházet z toho, že se mezi atomy myšleně přesune určité množství elektronů. Mějme nevyčíslenou reakci:
\mathrm{\overset{0}{P} + {H}\overset{V}{I}{O_3} + H_2O \longrightarrow {H_3}\overset{V}{P}{O_4} + H\overset{-I}{I}}
V rámci ní probíhají následující poloreakce. Aby bylo zajištěno zachování náboje, použijeme křížové pravidlo:
|
oxidace: \mathrm{\overset{0}{P} \longrightarrow \overset{V}{P} … 5\,e^-} redukce: \mathrm{\overset{V}{I} \longrightarrow \overset{-I}{I} … 6\,e^-} |
⤨ |
\overset{\phantom{I}}{6} \overset{\phantom{I}}{5} |
Získaná čísla zapíšeme před látky obsahující daný prvek: \mathrm{6\,P + 5\,HIO_3 + H_2O \longrightarrow 6\,H_3PO_4 + 5\,HI}
Nakonec rovnici dovyčíslíme, v tomto případě přidáním koeficientu ke vzorci vody: \mathrm{6\,P + 5\,HIO_3 + 9\,H_2O \longrightarrow 6\,H_3PO_4 + 5\,HI}
NahoruRedoxní reakce
Při oxidačně-redukčních (redoxních) reakcích dochází ke změnám oxidačních čísel atomů.
Oxidační číslo
Oxidační číslo je formální (myšlený) náboj, který by částice měla, kdyby se všechny elektrony účastnící se jejích vazeb přiřadily elektronegativnějšímu atomu. Oxidační číslo se zapisuje římskou číslicí jako horní index za (či nad) značku prvku, běžně nabývá hodnot od \mathrm{−IV} do \mathrm{VIII}. Elektricky neutrální částice samostatného prvku mají oxidační číslo \mathrm{0} (vzhledem ke stejné elektronegativitě jsou elektrony rovnoměrně rozděleny).
\mathrm{\overset{\scriptsize -IV}{C} \overset{\scriptsize I}{H_4}} – Atom uhlíku (\mathrm{C}) v methanu má oxidační číslo \mathrm{-IV}, atomy vodíku \mathrm{I}.
\mathrm{\overset{\scriptsize IV}{C} \overset{\scriptsize -II}{O_2}} – Atom uhlíku (\mathrm{C}) v oxidu uhličitém má oxidační číslo \mathrm{IV}, atomy kyslíku \mathrm{-II}.
\mathrm{\overset{\scriptsize 0}{O_2}} – Atomy kyslíku (\mathrm{O}) jakožto samostatného prvku mají oxidační číslo \mathrm{0}.
Jinými slovy: čím více (záporně nabitých) elektronů k atomu formálně přiřadíme, tím menší má oxidační číslo.
Oxidační čísla a názvosloví
Oxidační čísla souvisejí s tím, v jakém vzájemném poměru se prvky (atomy) vyskytují v určitých molekulách. Koncovky vyjadřující oxidační čísla atomů se zahrnují např. do názvů halogenidů, oxidů a dalších sloučenin.
Oxidace a redukce
Při oxidaci se oxidační číslo zvětšuje, dochází k myšlenému odevzdávání elektronů (myšlený náboj se stává „více kladným“). Při redukci se oxidační číslo zmenšuje, dochází k myšlenému přijímání elektronů (myšlený náboj se stává „více záporným“).
Oxidace a redukce probíhají současně: zatímco jedna částice elektrony formálně odevzdá, jiná je musí formálně přijmout.
\mathrm{2\,\overset{\scriptsize 0}{Fe} + 3\,\overset{\scriptsize 0}{O_2} \longrightarrow 2\,\overset{\scriptsize III}{Fe_2} \overset{\scriptsize -II}{O_3}}
V rámci reakce výše probíhají tyto poloreakce:
\mathrm{\overset{\scriptsize 0}{Fe} ⟶ \overset{\scriptsize III}{Fe}} – Železo se oxiduje ze stavu \mathrm{0} do stavu \mathrm{III}.
\mathrm{\overset{\scriptsize 0}{O} ⟶ \overset{\scriptsize -II}{O}} – Kyslík se redukuje ze stavu \mathrm{0} do stavu \mathrm{−II}.
Oxidační a redukční činidla
- Jako oxidační činidlo se označuje látka, která oxiduje jiné látky, sama se redukuje (typicky např. kyslík, manganistan draselný, chlor).
- Redukční činidlo redukuje jinou látku, samo se oxiduje (např. vodík a jeho sloučeniny, alkalické kovy, oxid uhelnatý).
Elektrochemie
Elektrochemie se zabývá ději, které se odehrávají na rozhraní elektrod a roztoku (elektrolytu), který obsahuje ionty a tak je schopen vést elektrický proud (zpravidla se jedná o vodný roztok či taveninu).
Elektrody
Elektrody bývají zhotovené z vodivého materiálu (kovů, polokovů či grafitu). Rozlišuje se:
- anoda – Probíhá na ní oxidace.
- katoda – Probíhá na ní redukce.
Elektrolýza
Elektrolýza je děj, při kterém působením stejnosměrného proudu dochází k chemickým změnám na elektrodách. Konkrétní děje ilustruje příklad elektrolýzy vodného roztoku \mathrm{CuCl_2}:
| Elektroda | Náboj (v případě elektrolýzy) | Probíhající děj | Reakce |
|---|---|---|---|
| katoda | záporný | redukce | \mathrm{Cu^{2+} + 2\,e^- \longrightarrow Cu^0} |
| anoda | kladný | oxidace | \mathrm{2\,Cl^– - 2\,e^- \longrightarrow Cl_2^0} |
Elektrolýza se často využívá k rozkladu výchozích látek a výrobě látek samostatných: např. sodíku, hliníku, chloru či čistého kyslíku pro využití v lékařství.
Galvanické články
Galvanický článek je zdrojem stejnosměrného proudu. Ten vzniká na základě redoxních reakcí na elektrodách (dochází k přesunu elektronů mezi látkami). Mezi běžné typy galvanických článků („baterií“) patří např. alkalický článek:
| Elektroda | Náboj (v případě galvanického článku) | Probíhající děj | Materiál |
|---|---|---|---|
| katoda | kladný | redukce | \mathrm{MnO_2} |
| anoda | záporný | oxidace | \mathrm{Zn} v roztoku \mathrm{KOH} |
Celková reakce při vybíjení alkalického článku: \mathrm{Zn + 2\,MnO_2 \longrightarrow ZnO + Mn_2O_3}.
Akumulátory lze opakovaně nabíjet a vybíjet, příkladem je lithium-iontový akumulátor (Li-ion) používaný např. v noteboocích, smartphonech či elektromobilech.
Co je „baterie“?
V úzkém pojetí se za baterii považují sériově zapojené galvanické články. Běžně se toto označení však používá i pro jednotlivé články a akumulátory („nabíjecí baterie“).
Kyselost a zásaditost roztoků, pH
Kyselost/zásaditost roztoků
Míra kyselosti či zásaditosti roztoku se vyjadřuje pomocí pH:
- Roztoky, které mají pH 7, jsou neutrální, např. destilovaná voda.
- Roztoky s pH menším než 7 jsou kyselé, např. citronová šťáva, ocet.
- Roztoky s pH větším než 7 jsou zásadité, např. roztok hydroxidu.
Pro výpočet pH zjednodušeně platí vztah \mathrm{pH = -log[H^+]}, kde \mathrm{[H^+]} je koncentrace kationtů vodíku. Čím více iontů \mathrm{H^+} (respektive \mathrm{H_3O^+}) roztok obsahuje, tím je kyselejší. Koncentrace \mathrm{H^+} a tedy i pH jsou závislé na teplotě. Běžné hodnoty pH jsou od 0 do 14.
Zjišťování pH
Orientačně měřit pH lze pomocí acidobazických indikátorů (např. fenolftalein – a, lakmus). To jsou látky, které mění své zbarvení v závislosti na pH. Indikátory jsou součástí univerzálních indikátorových papírků (b). Přesně lze pH změřit instrumentálně pomocí pH metrů (c), ty často využívají skleněnou elektrodu.



Praktický význam pH
Mnohé skutečnosti bezprostředně ovlivňující člověka jsou spojeny s pH:
- Tělní tekutiny (např. krev, sliny) mají pH v určitém rozsahu, jinak by nemohly plnit svoji funkci.
- V souvislosti se životním prostředím jsou problémem např. kyselé deště či pozvolné okyselování oceánů vlivem stoupající koncentrace \mathrm{CO_2}.
- Konkrétní hodnotu pH je mnohdy nutné dodržovat při určitých technologických postupech, např. při výrobě potravin.
- Půdní roztok se vyznačuje určitým pH, což ovlivňuje pěstování rostlin (včetně zemědělských plodin).
- Hodnota pH ovlivňuje různé další organismy: např. to, zda se v akváriu bude dařit chovaným rybám, nebo zda se v bazénu budou množit sinice a řasy.
Látkové množství, molární hmotnost
Látkové množství
Látkové množství obvykle přeneseně vyjadřuje počet částic (atomů, iontů, molekul). Značí se n, jeho jednotka je \mathrm{mol}.
\mathrm{1\;mol} látky obsahuje přesně 6{,}022\,140\,76 \cdot 10^{23} částic. Toto číslo se označuje jako Avogadrova konstanta, značí se N_A.
Platí tedy vztah n = \frac{N}{N_A}, kde n je látkové množství, N_A je Avogadrova konstanta a N je skutečný počet částic.
Příklad
Jakému látkovému množství odpovídá 3{,}011 \cdot 10^{23} atomů zlata?
Látkové množství (n) spočítáme tak, že zjistíme podíl reálného počtu částic (3{,}011 \cdot 10^{23}) a počtu částic v jednom mol látky (6{,}022 \cdot 10^{23}). Dosadíme: n = \frac{N}{N_A} = \frac{3{,}011 \cdot 10^{23}}{6{,}022 \cdot 10^{23}} = 0{,}5. Látkové množství atomů zlata je 0,5 mol.
Molární hmotnost
Molární hmotnost (M, jednotka \mathrm{g/mol}) vyjadřuje hmotnost určitého látkového množství látky. Molární hmotnost lze spočítat na základě relativních atomových hmotností uvedených v periodické tabulce.
Tedy například molární hmotnost dvouatomové molekuly kyslíku (A_r = 16{,}00) se spočte takto: M_{\mathrm{O_2}} = 2 \cdot 16 = 32\;\mathrm{g/mol}.
Výpočty na základě látkového množství a molární hmotnosti
Na základě látkového množství a molární hmotnosti látky lze spočítat hmotnost (m) dle vztahu m = n \cdot M. Naopak látkové množství je možné spočítat na základě hmotnosti a molární hmotnosti: n = \frac{m}{M}.
Koncept látkového množství je tedy užitečný např. pro zjišťování množství látek v rámci chemických reakcí. Například při rozkladu vody na vodík a kyslík (\mathrm{2\;H_2O \longrightarrow 2\;H_2 + O_2}) ze 2 mol vody vznikají 2 mol dvouatomových molekul vodíku. Tyto látky mají odpovídající látkové množství, ale budou se lišit svou hmotností.
NahoruVýpočty z chemických rovnic
Z chemických rovnic lze vypočítat např. látkové množství či hmotnost jednotlivých zúčastněných látek. Je nutné ovládat výpočty spojené s látkovým množstvím.
Při výpočtech z rovnic je potřeba vycházet ze stechiometrických koeficientů. Např. v rámci reakce \mathrm{2\;H_2 + O_2 \longrightarrow 2\;H_2O} ze 2 mol vodíku a 1 mol kyslíku vznikají 2 mol vody. Pokud by měly vzniknout 4 mol vody (dvakrát tolik), bylo by potřeba 4 mol vodíku a 2 mol kyslíku.
Reagující látky si (s přihlédnutím ke stechiometrickým koeficientům) odpovídají svým látkovým množstvím. Tedy např. ke vzniku 18 g vody (n = 1\;{\mathrm{mol}}; M = 18\;\mathrm{g/mol}) by bylo potřeba 2 g vodíku (n = 1\;{\mathrm{mol}}; M = 2\;\mathrm{g/mol}) a 16 g kyslíku (n = 0{,}5\;{\mathrm{mol}}; M = 32\;\mathrm{g/mol}).
NahoruLátková koncentrace
Látková koncentrace je veličina popisující látkové množství v určitém objemu látky (obvykle roztoku). Značí se c, obvykle užívanou jednotkou je \mathrm{mol/dm^3} (v jednotkách SI pak \mathrm{mol/m^3}).
Čím je roztok koncentrovanější, tím více určité složky obsahuje (respektive tím obsahuje větší látkové množství této složky).
Látková koncentrace se spočítá podle vztahu c = \frac{n}{V}, kde n je látkové množství v \mathrm{mol} a V je celkový objem v \mathrm{dm^3}.
NahoruHmotnostní zlomek
Hmotnostní zlomek vyjadřuje podíl hmotnosti části ve vztahu k celku, obvykle se používá při vyjadřování složení směsí. Je to bezrozměrná veličina. Značí se w. Nabývá hodnoty od 0 do 1, často se vyjadřuje v procentech (též hmotnostní procento).
Hmotnostní zlomek (w) lze vypočítat takto: w = \frac{m}{m_c}, kde m je hmotnost části (určité látky) a m_c je hmotnost celé směsi.
Příklad: známe hmotnost části a hmotnost celé směsi
150 g jogurtu obsahuje 7,5 g bílkovin. Jaký je hmotnostní zlomek bílkovin v jogurtu?
Konkrétní část směsi, tedy bílkoviny (m), váží 7,5 g. Celá směs, tedy jogurt (m_c), váží 150 g. Na základě těchto hodnot spočítáme hmotnostní zlomek: w = \frac{m}{m_c} = \frac{7{,}5\,\mathrm{g}}{150\,\mathrm{g}} = 0{,}05. V jogurtu je tedy \frac{5}{100} neboli 5 % bílkovin, jinými slovy 5 % hmotnosti jogurtu je tvořeno bílkovinami.
Vztah pro hmotnostní zlomek je samozřejmě možné upravit a spočítat tak:
- hmotnost části směsi (na základě znalosti hmotnostního zlomku a celkové hmotnosti): m = w \cdot m_c
- hmotnost celé směsi (na základě znalosti hmotnosti části a hmotnostního zlomku): m_c = \frac{m}{w}
Hmotnostní zlomek se mnohdy počítá pro roztoky tvořené určitou látkou a rozpouštědlem. Celková hmotnost směsi (m_c) je v takovém případě součtem hmotnosti látky a hmotnosti rozpouštědla: w = \frac{m}{m_c} = \frac{m_\mathrm{látka}}{m_\mathrm{látka} + m_\mathrm{rozpouštědlo}}
Příklad: známe hmotnost části a hmotnost rozpouštědla
10 g soli jsme rozpustili v 90 g vody. Jaký je hmotnostní zlomek soli ve vodě?
Rozpuštěná látka má hmotnost 10 g, celková hmotnost roztoku je součtem hmotnosti rozpuštěné látky (soli) a rozpouštědla (vody), tedy: w = \frac{m}{m_c} = \frac{m_\mathrm{soli}}{m_\mathrm{soli} + m_\mathrm{vody}} = \frac{10\,\mathrm{g}}{10\,\mathrm{g} + 90\,\mathrm{g}} = \frac{10\,\mathrm{g}}{100\,\mathrm{g}} = 0{,}1. Hmotnostní zlomek soli ve vodě je 0,1.
Výpočty hmotnostního zlomku jsou v podstatě obdobné výpočtům s procenty. Mj. je dobré si uvědomit, že hmotnost části směsi je vždy menší než hmotnost celé směsi – jinými slovy část směsi nemůže tvořit více než 100 % její hmotnosti (např. 100 g medu z principu nemůže obsahovat 110 g cukru).
NahoruVýpočty z chemických vzorců
Hmotnostní zlomek prvku ve sloučenině lze spočítat jako poměr molární hmotnosti tohoto prvku ku molární hmotnosti celé molekuly (sloučeniny): w_{\mathrm{prvku}}=\frac{a{\cdot}M_{\mathrm{prvku}}}{M_{\mathrm{sloučeniny}}} (a je počet atomů daného prvku).
Například relativní atomová hmotnost vodíku je 1,01, relativní atomová hmotnost kyslíku 16,00. Hmotnostní zlomek vodíku ve vodě (\mathrm{H_2O}) se spočítá jako \frac{2 \cdot 1,01}{2 \cdot 1,01 + 16{,}00} = 0{,}11.
NahoruSkupiny chemických látek
Chemické látky/sloučeniny se dělí do určitých skupin. Může jít o samostatné prvky. Chemické sloučeniny se pak rozdělují podle toho, které prvky ve svých molekulách obsahují, případně jak jsou tyto prvky navzájem navázané.
Sloučeniny lze v základu rozdělit na anorganické a organické (ty zahrnují složitější sloučeniny uhlíku – \mathrm{C}). Základní přehled ve skupinách látek je užitečný třeba při rozebírání chemických látek podle určitého tématu, například si lze uvědomit souvislost vlastností látky s jejím chemickým složením.
Následující soupis obsahuje skupiny látek, jejichž rozlišování je procvičováno v rámci tohoto tématu. Zároveň obsahuje odkazy na jiná témata – vždy věnovaná jen konkrétní skupině.
Anorganické sloučeniny
- halogenidy – Sloučeniny halogenů (prvků 17. skupiny) a elektropozitivnějších prvků, např. chlorid sodný (\mathrm{NaCl}).
- oxidy – Sloučeniny kyslíku s dalšími prvky, např. oxid uhličitý (\mathrm{CO_2}).
- anorganické kyseliny – Látky schopné odštěpovat kation vodíku (\mathrm{H^+}), např. kyselina sírová (\mathrm{H_2SO_4}).
- hydroxidy – Látky zásaditého charakteru, jsou schopné přijímat kation vodíku. Obsahují hydroxidovou skupinu (\mathrm{OH^-}). Příkladem je hydroxid sodný (\mathrm{NaOH}).
- anorganické soli – Vznikají například reakcí kyselin a hydroxidů. Atom vodíku (který byl v původní molekule kyseliny) je obvykle nahrazen atomem kovu. Příkladem je uhličitan vápenatý (\mathrm{CaCO_3}).
Organické sloučeniny
- uhlovodíky – Sloučeniny uhlíku a vodíku, například ethan (\mathrm{C_2H_6}).
- deriváty uhlovodíků – Látky vycházející z uhlovodíků, kde atom či atomy vodíku byly nahrazeny jinými atomy či skupinami. Patří sem halogenderiváty uhlovodíků, alkoholy, aldehydy a ketony nebo karboxylové kyseliny (např. kyselina octová – \mathrm{CH_3COOH}).





